Son muchos, pero se les escucha poco. Las familias con miembros afectados por enfermedades raras (EERR), muchos de ellos niños, viven cada día con una mezcla de ilusión y desesperanza. Ilusión por ver si hoy, después de años de peregrinaje de consulta en consulta, será ese día en el que puedan confirmar su diagnóstico u optar a un medicamento efectivo para su enfermedad. Desesperanza por ver que el tiempo pasa, y no pasa igual para todos.
Este tipo de enfermedades suele ser de origen genético (80%), y un 65% de ellas son de carácter crónico y degenerativas. Los primeros síntomas suelen aparecer a los pocos meses de nacer, ya que muchas de estas enfermedades están fuera del cribaje universal neonatal. En otros casos, los síntomas pueden no manifestarse o pasar desapercibidos en la infancia y es en la adolescencia o incluso en la edad adulta, cuando salen a la luz.
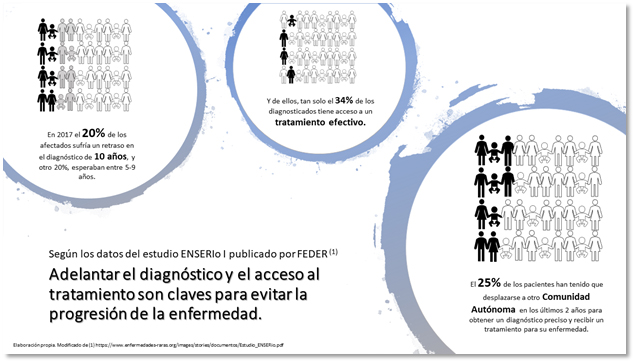
A partir de este momento, comienza la cuenta atrás para muchas familias, dejando todo para luchar contra una enfermedad de la que nunca han oído hablar. El 25% de los pacientes han tenido que trasladarse a otra comunidad autónoma en los últimos 2 años para ser diagnosticados o recibir el tratamiento autorizado. 17 comunidades autónomas (CCAA), 17 entornos sanitarios. Dado que la mayoría de las competencias en materia de sanidad están transferidas, cada CCAA presenta su propia forma de gestionar el acceso de los medicamentos, generándose distintos arquetipos en base a cada uno de estos modelos. Son datos del primer Estudio sobre Necesidades Sociosanitarias de las Personas con Enfermedades Raras en España (Estudio ENSERio I), que publicó la Federación Española de Enfermedades Raras (FEDER) el año pasado junto al Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) (1), y donde también se pone de manifiesto que puede haber hasta 15 millones de afectados por una enfermedad poco frecuente en la Unión Europea (la Europa de los 27), aunque muchos de ellos aún no lo saben (2).
El desconocimiento que rodea a estas patologías, la dificultad de acceso a la información unido al pequeño número de afectados de cada una de ellas y la dispersión geográfica de los pacientes, hacen que el 20% de estas personas esperen más de una década para obtener un diagnóstico preciso, y que un porcentaje similar tarden entre 4 y 9 años.
Para muchos otros pacientes esto puede no tener fin, dado que solo tiene acceso a un tratamiento efectivo el 34% del colectivo. Estas cifras traen consigo un aislamiento social que hace que todas estas familias vivan sus vidas con en un enorme desequilibrio emocional (1).
Afortunadamente, la ciencia y la tecnología siguen avanzando. En la investigación básica y traslacional, se abren prometedores caminos para la identificación de nuevas dianas terapéuticas que sirvan como biomarcadores claves, tanto en el diagnóstico precoz como en el seguimiento de las enfermedades, así como en generar nuevos enfoques terapéuticos. Las técnicas actuales de investigación basadas en la tecnología CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), como herramienta molecular utilizada para “editar” o “corregir” el genoma de cualquier célula, han demostrado resultados positivos en modelos animales abriendo un nuevo campo de tratamiento basado en la terapia génica (3).
La investigación básica es fundamental para un mayor avance conceptual en este ámbito. Desde hace ya 20 años, el Reglamento 141/2000 de la Unión Europea establece incentivos en aras a la promoción de la investigación, desarrollo y comercialización de medicamentos, destinados a tratar enfermedades raras con el objetivo de paliar la falta de conocimiento científico de estas patologías. Esta normativa ha tenido un impacto positivo en la investigación de medicamentos huérfanos. Según un estudio realizado por Pugach Concillium (2019), en Europa, entre 2006 y 2016, ha habido un incremento en la puesta en marcha de ensayos clínicos (EECC) para enfermedades raras, donde Francia y España son los países con un mayor crecimiento. Aun así, si comparamos a España con el resto de los países de la Unión Europea, sigue teniendo uno de los niveles más bajos de actividad en cuanto a EECC.
Por otro lado, se ha mejorado en el conocimiento de estas patologías a través de iniciativas como EURORDIS, (EUropean Reference network On Rare DISeases) propuesta en 2017, con apoyo de la Comisión Europea y el Parlamento Europeo y que establece en Europa una red de centros expertos para compartir el conocimiento, abordaje o recursos, mejorando la atención al paciente en su centro o país de residencia (con el impacto que ello tiene en su calidad de vida). En España, gracias a la ampliación de Centros de Referencia (CSUR) y a la creación de Registros Nacionales, se ha logrado aumentar el conocimiento clínico y la especialización de los profesionales sanitarios, y la cuantificación de la prevalencia de las patologías. Así se está facilitando la entrada de más pacientes en registros y con ello intentando acortar los tiempos hasta obtener un diagnóstico y en caso de existir, un tratamiento. Y es que, de las más de 6.000 EERR descritas tan solo existe tratamiento efectivo para el 6% de todas las patologías (4).
En este contexto, la única esperanza de seguir viviendo para muchos de estos pacientes es optar a un uso compasivo y con suerte, entrar en un ensayo clínico, asumiendo y aceptando los riesgos potenciales, al no tener alternativa terapéutica alguna.
Los registros de pacientes, en muchos casos impulsados por las propias asociaciones de pacientes, son claves para agrupar enfermos que potencialmente puedan entrar en estos EECC. Por ello, es vital la participación de las asociaciones de pacientes en todo el proceso (desde el inicio de la investigación básica, preclínica y clínica), así como en el diagnóstico precoz y en los procesos de evaluación y aprobación de nuevos tratamientos. Actualmente, las asociaciones de pacientes están presentes en grupos de trabajo y comités científicos de las agencias reguladoras como la Agencia Europea del Medicamento (EMA) o la Agencia Española del Medicamento y Productos Sanitarios (AEMPS), y se están incorporando a los Comités asesores de algunas CCAA, que han entendido la importancia de la complementariedad de su visión; una de sus aportaciones ha sido la colaboración en la identificación de “clúster” de pacientes, vehiculizando las necesidades de este colectivo a fin de hacer más efectiva la toma de decisiones.
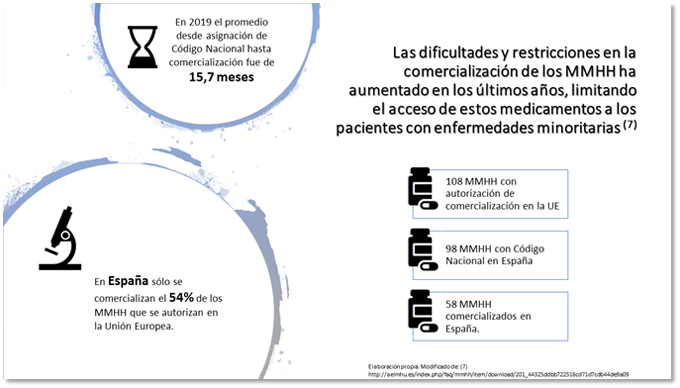
La actual coyuntura socio-económica, con un aumento de la esperanza de vida y un incremento de las necesidades y recursos sanitarios de la población, junto a una situación política inestable en España, ponen en riesgo la sostenibilidad del Sistema Nacional de Salud que, por otro lado, debe garantizar el acceso a la innovación terapéutica. La actual encrucijada entre la innovación de alto coste, el acceso a los nuevos medicamentos y la sostenibilidad está influyendo en el número de medicamentos que se están comercializando en nuestro país en los últimos años respecto a décadas anteriores. Este hecho es palpable, donde solo un 54% de los medicamentos huérfanos con autorización de comercialización de la Unión Europea son comercializados finalmente en nuestro país, es decir, 58 de 108. La correlación entre autorización y financiación ha pasado de ser del 90,5% en el periodo 2002-2011 al 29,5% en el periodo 2012-2015.
Adicionalmente, el tiempo transcurrido desde la obtención de Código Nacional hasta la obtención de precio y financiación es de 14,6 +/- 9 meses, aumentando en 3,8 meses en el último año, datos que ahondan la brecha del acceso de estos medicamentos. No obstante, a pesar del incremento del intervalo de tiempo en la aprobación efectiva, a fecha septiembre de 2019 se han comercializado más medicamentos huérfanos (10) que en todo el año 2018 (8), son datos facilitados por la Asociación Española de Laboratorios de Medicamentos Huérfanos (AELMHU) (5,6).
En la actualidad, un nuevo medicamento para una enfermedad rara que obtiene financiación en nuestro país suele ir ligado a una autorización condicionada a la obtención de nuevos datos de EECC o de datos complementarios de vida real que confirmen los beneficios clínicos esperados, o bien, a alguna modalidad de acuerdo innovador o de pago por resultados, a fin de minimizar los riesgos y las incertidumbres para el propio SNS. Se trata de acuerdos financieros complejos con registro de variables clínicas, que necesitan que las organizaciones implicadas, cuenten con profesionales más preparados y estructuras organizativas con la capacidad y las competencias técnicas adecuadas, para dar respuesta a todas las necesidades derivadas de los nuevos modelos de financiación, tanto interna como externamente.
Desde el ámbito de la industria farmacéutica, los responsables del acceso al mercado de los medicamentos se establecen como figuras clave para implementar estos nuevos modelos de financiación, que requieren dominar distintas habilidades y competencias técnicas, como la capacidad de análisis farmacoeconómico, la negociación o la comunicación efectiva, además de agilidad y flexibilidad en la toma de decisiones, y la capacidad de liderazgo para impulsar y movilizar internamente a los departamentos implicados: regulatorios, clínicos y financieros. Todo ello hace que el perfil de los integrantes de estos departamentos sea cada vez más exigente. La formación y profesionalización de los equipos de acceso al mercado se hace cada vez más patente y necesaria en todas las fases del proceso, obligados a conocer al detalle los procedimientos, comités y departamentos implicados en un entorno muy cambiante.
Como recordábamos al inicio, el tiempo no pasa igual para todos, y debemos tenerlo muy presente; la agilización de los procesos y minimización de los tiempos debe ser una prioridad tanto para la Administración como para las compañías farmacéuticas. Los responsables de acceso al mercado tienen un objetivo común y una clara motivación: que los medicamentos estén disponibles cuanto antes para este tipo de pacientes en las mejores condiciones posibles, equilibrando esta aspiración con los legítimos intereses de la empresa privada, la disponibilidad a pagar y el coste de oportunidad que pueda suponer para la administración.
Es, sin duda, un entramado complejo, por lo que no podemos olvidar una cualidad fundamental: la empatía. Somos personas que estamos trabajando para mejorar la salud de las personas.
(1) Datos recogidos en el Estudio sobre necesidades Sociosanitarias de pacientes con EERR I, de la FEDER, disponible en:
https://www.enfermedades-raras.org/images/stories/documentos/Estudio_ENSERio.pdf
(2) Según los datos de la Dirección General de Sanidad y protección de los consumidores de la Comisión Europea, se considera que entre 5.000 y 8.000 Enfermedades Raras distintas afectan hasta a un 6 % de la población total de la Unión Europea en algún momento de la vida. Es decir, alrededor de 15 millones de personas en la Unión Europea (la Europa de los 27) están o se verán afectadas por una enfermedad rara
(3) The CRISPR page at CNB: http://wwwuser.cnb.csic.es/~montoliu/CRISPR/
(4) Datos facilitados por AELMHU, accesibles:
http://aelmhu.es/index.php/entrevistas/item/15-el-objetivo-para-2020-es-tener-200-medicamentos-aprobados-y-estamos-seguros-de-que-lo-vamos-a-conseguir
(5) Datos facilitados por AELMHU, accesibles:
http://aelmhu.es/index.php/actividades/eventos-aelmhu/item/909-aelmhu-presenta-los-datos-de-acceso-a-los-medicamentos-huerfanos-en-espana
(6) Listado completo medicamentos huérfanos aprobados en Europa (octubre 2019) Informes Periódicos de Orphanet, Serie Medicamentos Huérfanos. Octubre 2019 http://www.orpha.net/orphacom/cahiers/docs/ES/listado_de_medicamentos_huerfanos_in_Europa.pdf
(7) Infografía:
http://aelmhu.es/index.php/faq/mmhh/item/download/201_44325ddbb722516cd71d7cdb44de9a09
Mas información:
@FEDER: https://enfermedades-raras.org
@AELMHU: https://www.aelmhu.es
@CIBERER: https://www.ciberer.es
@ORPHANET: https://www.orpha.net















