La industria farmacéutica es uno de los impulsores claves en el desarrollo de la medicina personalizada. Este abordaje de la medicina y atención al paciente constituye una gran oportunidad para el ecosistema sanitario en ganar eficiencia. Sin embargo, no debemos obviar la multitud de cambios del entorno que deben ser desarrollados para su implantación exitosa: infraestructuras, marco normativo, nuevas tecnologías, distintas formas de trabajo por parte de los profesionales sanitarios… ¿Cómo están de preparados los sistemas sanitarios para asumir esta transformación desde el punto de vista de acceso? ¿En qué nuevos ámbitos nos debemos mover desde los departamentos de acceso para colaborar con la administración y hacer de este avance médico una realidad para el paciente?
En los últimos años tendemos cada vez más a buscar soluciones que nos permitan implementar políticas sanitarias basadas en la evidencia. Esto nos lleva a una evolución de los sistemas sanitarios en torno a la mejora del acceso a tratamientos (no sólo farmacológicos) que incrementen el beneficio clínico al paciente y su calidad de vida, que mejoren los resultados en salud y que al mismo tiempo permitan medir las inversiones en salud necesarias para llevarlas a cabo.
Estas políticas requieren que la toma de decisiones esté sustentada por datos combinados procedentes de la realidad del paciente y observaciones cuantificables; a su vez, que estos datos permitan evaluar la eficacia y la eficiencia de las medidas adoptadas.
En paralelo y muy alineado con estas necesidades, nos encontramos en un proceso de transformación hacia la implantación de la medicina personalizada, siendo la patología oncológica un ejemplo paradigmático actualmente.

Gracias a numerosos avances tecnológicos, llegaremos cada vez más a determinar lo que caracteriza al paciente de forma individualizada; como consecuencia, cada día estamos más cerca de facilitar una atención personalizada en función de los antecedentes médicos personales, el estado fisiológico y las características moleculares de cada individuo. Cada día encontramos avances en la mejora de la prevención, el diagnóstico, el tratamiento y el seguimiento del paciente.
Ejes de la medicina personalizada y su impacto en el acceso
La evolución en la prevención, el diagnóstico, el tratamiento y el seguimiento del paciente no sería posible si la ciencia no empujase avances que permitan una mayor comprensión de la biología molecular, una mejor caracterización de la enfermedad y una estructura de recogida de datos que permitan comprobarlo.
Entre estos avances, podemos destacar en primer lugar las mejoras en el campo del diagnóstico gracias al desarrollo de la información molecular. Tecnologías como la secuenciación masiva nos ayudan a mapear la composición genética de un individuo, las mutaciones en su tumor e incluso otras características moleculares adicionales y decisivas para encontrar el tratamiento más adecuado. Las biopsias líquidas además de ser una técnica diagnóstica excelente para aquellos pacientes en donde no existe o no hay acceso a tejido accesible para biopsiar, nos permiten llevar un seguimiento longitudinal no invasivo de la evolución del cáncer. Son una excelente herramienta para un ajuste dinámico del tratamiento ya que permiten conocer de forma no invasiva, los cambios a nivel genómico que se han producido a lo largo de la enfermedad.
¿Está preparado el sistema para la incorporación de nuevos avances tecnológicos que nos permitirán hacer un diagnóstico más exhaustivo? Entre otras funciones, es clave el compartir con gestores y agencias de evaluación las ventajas de las nuevas técnicas genómicas y su beneficio al sistema. Teniendo en cuenta su rápida evolución y necesidad urgente de implantación, desde los departamentos de acceso deberíamos poder plantear conjuntamente con la administración y profesionales sanitarios proyectos que demuestren la eficiencia de las mismas.
En segundo lugar, destaco como clave en el desarrollo de la medicina personalizada el incremento de dianas terapéuticas que en patologías como el cáncer han sido clave para la multiplicación de terapias dirigidas.
En la figura 1 se puede ver un ejemplo de este concepto.
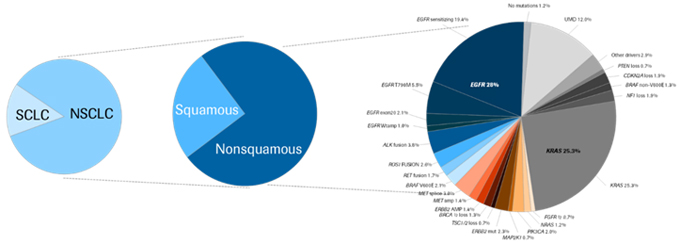
Figura 1
Podemos ver en el esquema la evolución del diagnóstico en cáncer de pulmón: tradicionalmente, las clasificaciones en oncología se basaban en gran medida en el tipo de tumor y la histología. Actualmente el foco ha cambiado hacia determinar alteraciones genómicas específicas o biomarcadores. Y por consiguiente, hacia un desarrollo de fármacos con eficacia específica para un perfil de paciente concreto; las poblaciones determinadas para un tipo de terapia son cada vez de menor tamaño y con características más concretas.
Este desarrollo en el campo de las mutaciones, ha propiciado también un cambio de paradigma en la investigación. Tengamos en cuenta por ejemplo el cambio en oncología, donde estamos pasando de ensayos de tipo paraguas (en donde la selección de los pacientes se basa en el origen del tumor: mama, pulmón…) a ‘ensayos en cestas’ (basket trials, en inglés), en los que selección de los pacientes no se basa en el origen del tumor sino en la presencia de una mutación con independencia de su localización.
Y la pregunta viene ahora, ¿cómo encajar el acceso de este tipo de fármacos, cuyos ensayos clínicos tienen una estructura totalmente diferente a lo que las agencias reguladoras tienen como referente? ¿Cómo hacer un abordaje para alcanzar el reembolso para poblaciones con una n sustancialmente menor a lo que de forma tradicional se tiene en cuenta? ¿Cómo se enfrentan las agencias reguladoras a la evidencia de este tipo de ensayos?
Es por ello que el tercer de los pilares para el desarrollo de la medicina personalizada es el dato. Es un activo de incalculable valor siempre que cuide su recolección, tratamiento, integración y gestión.
Y cuando hablamos de datos, no sólo nos referimos a aquellos procedentes de ensayos. Las fuentes ahora se multiplican: imágenes avanzadas, historias clínicas electrónicas, patología digital, telemedicina, app, sensores y wearables, datos genómicos, datos procedentes de inteligencia artificial, Real World Data (RWD) …
La administración española es consciente de la importancia de la recogida estructurada de información. Como ejemplo de esta apuesta por el seguimiento y por tanto de la gestión del dato lo encontramos Valtermed, sistema para la medición del valor terapéutico de los medicamentos y sus resultados en salud.
En relación al dato debemos también tener en cuenta el papel del Big Data; se dibuja como una excelente herramienta para la transformación de los datos en información útil, interpretable por los diferentes agentes: investigadores, clínicos, pagadores, etc y por lo tanto un apoyo clave a la hora de tomar decisiones clínicas y también de acceso.
En concreto, el RWD por su cantidad y su enfoque de medir al paciente en un entorno no controlado (ver figura 2), tiene el poder de cerrar brechas de conocimiento y complementar los ensayos clínicos aleatorizados, pilar de futuras aprobaciones.
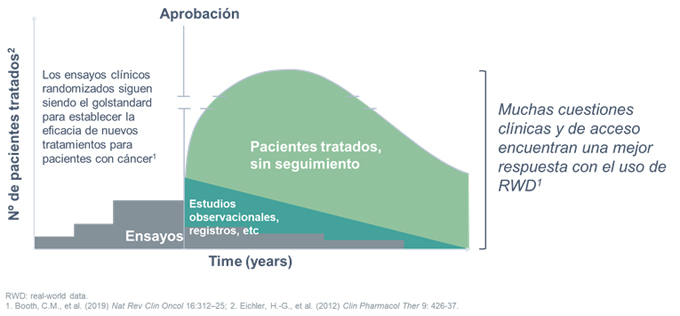
Figura 2
El uso del RWD para hacer la comparación en ensayos clínicos podría reducir la necesidad de disponer de grupos control (Davies, J., et al. (2018) J Comp Eff Res 7:855-65); con la consiguiente reducción de costes en I+D, aumentando la agilidad en el desarrollo clínico y por lo tanto acelerando su entrada al mercado. Como vemos, a pesar de las dificultades que trae la organización y gestión de datos, el mundo farma encuentra una gran oportunidad aquí, ya que disponer de bases de datos organizadas será clave para mejorar la evidencia sobre el funcionamiento en vida real de los fármacos comercializados y además una guía para el desarrollo de futuras terapias. La pregunta es: ¿cómo de preparados están las agencias reguladoras y pagadores para aceptar esta evidencia en el medio plazo? Es crucial un trabajo por parte de acceso de concienciación de las oportunidades, validez y beneficio de este nuevo abordaje para estos stakeholders.
Agencias como la FDA ven posible aceptar el uso de RWD para aprobaciones iniciales de moléculas que vienen a cubrir lagunas terapéuticas; estamos en la dirección de que se evalúen fármacos con datos de vida real de comparadores y así poder describir el curso natural de la enfermedad. Sin embargo, será clave apoyar la formación a reguladores sobre esta evolución a la hora de manejar la validez de esta nueva evidencia científica
Nuevos modelos de relación con la administración
Por último, resaltar que la medicina personalizada requiere una evolución de las necesidades del sistema sanitario; esto nos lleva a formas distintas de relación de ésta con sus proveedores.
Esta transformación se traduce en un cambio en los modelos de contratación de las administraciones públicas. Nos encaminamos hacia el desarrollo de mecanismos que permitan evolucionar la compra de productos hacia la compra de servicios o resultados de salud.
La tendencia del pago por producto (regulación de precio) no sólo ha dado paso a los acuerdos de riesgo compartido sino que evoluciona a contratos de producto+servicio asociado e incluso nos planteamos llegar a la contratación de servicios integrados, la compra de resultados. El valor no está en el producto en sí mismo, sino en los resultados de salud proporcionados por el servicio integral que se contrata. ¿Podremos ver la compra de un test sumada a un tratamiento y un servicio de monitorización licitada en el mercado como algo habitual? La triada típica de la medicina personalizada: diagnóstico-tratamiento-seguimiento lo hace posible y sobre todo lo convertirá en una realidad frecuente cuando se articule una adecuada gestión de los sistemas de información.
Estas nuevas formas de contratación pueden también encontrar un aliado en la compra pública de innovación (CPI), un instrumento de política y actuación administrativa que se apoya en la contratación pública como medida de fomento de la innovación. La CPI está ahora también presente en el campo de la salud y ya está siendo utilizada a nivel regional y por parte de instituciones sanitarias para el desarrollo de soluciones innovadoras que favorezcan la implantación de la medicina personalizada. Un instrumento por lo tanto a conocer, trabajar y desarrollar entre estos actores sanitarios y los departamentos de acceso de la industria farmacéutica.
Los beneficios de la medicina personalizada han venido para quedarse. Eso sí, vienen con un compañero de viaje, el gran reto que supone una transformación del ecosistema sanitario en varios niveles: desde investigadores, pacientes, cuidadores, clínicos, pagadores sin olvidar a la industria farmacéutica.
Y como parte implicada del cambio, los departamentos de acceso deberemos estar preparados para afrontar un nuevo abordaje a la hora de enfrentarnos a procesos de colaboración con la administración, en cuanto a la evaluación, aprobación, financiación y seguimiento de fármacos y técnicas diagnósticas. Sólo así conseguiremos conseguir una mejor atención al paciente y un aprovechamiento más racional de los recursos sanitarios.
















