La era de la medicina en el mundo real está evolucionando muy deprisa y no hay mejor momento que el presente para involucrarse en el Real World Data (RWD), dado que los Financiadores de los servicios de Salud están demandando este tipo de evidencias. Principalmente hay un creciente interés en los Patient Reported Outcomes (PROs) dado que proveen una visión muy completa de la efectividad de los tratamientos.
Como bien sabemos, los pacientes que participan en los ensayos clínicos han de ser cuidadosamente elegidos para asegurar que los resultados no se deben a alguna otra condición o tratamiento que el enfermo pudiera estar recibiendo, sino al fármaco objeto de estudio. Esto tiene la ventaja de aportar evidencia e información muy valiosa respecto a la seguridad y eficacia del medicamento, sin embargo no arroja información sobre el modo en que los pacientes responderán al fármaco en la vida real, cuando estén en otras condiciones no tan controladas y cuando estén tomando múltiples medicamentos, diferentes a los que tomaban en el contexto del ensayo clínico.
Lo anteriormente expuesto nos hace adentrarnos en el concepto del Real World Data (RWD). La International Society for Pharmacoeconomics and Outcomes Research (ISPOR), define RWD como “aquellos datos usados por los decisores que no son obtenidos de los ensayos clínicos convencionales”. En otras palabras, es la recogida de datos sobre medicamentos, pacientes y enfermedades en un contexto no experimental.
Las compañías farmacéuticas han generado RWD fundamentalmente con el objetivo de cumplir las normativas en farmacovigilancia y post-comercialización. Es por ello que se obtienen multitud de datos en el mundo real de distintos fármacos, desde la perspectiva de la seguridad del medicamento. En los últimos años las exigencias de las Agencias Regulatorias han aumentado y la necesidad en RWD ha ido creciendo en términos de farmacovigilancia.
En Europa, la legislación requiere que las compañías elaboren sus planes de “risk-management” cuando solicitan a la EMA (Agencia Europea del Medicamento) la autorización de comercialización. Adicionalmente, se han puesto en marcha proyectos ambiciosos a nivel europeo, por ejemplo, el EU-ADR, que es un proyecto diseñado para detectar reacciones adversas a fármacos vía Electronic Health Records (EHR) de más de 30 millones de pacientes de varios países europeos.
Más allá de la farmacovigilancia, el RWD esencialmente nos abre las puertas hacia una nueva dimensión, ya que nos aporta una información que los ensayos clínicos no pueden. ¿Por qué el RWD es útil? Principalmente lo es por varios motivos:
1) Detecta poblaciones de pacientes en las que el producto funciona mejor.
2) Detecta si su uso es óptimo , por ejemplo, si se está utilizando a la dosis que la compañía farmacéutica recomienda.
3) Nos permite captar outcomes directamente del paciente en el mundo real.
4) Confirma la eficacia y seguridad del medicamento en el mundo real.
5) Permite diferenciar nuestro medicamento frente a la competencia.
6) Nos ayuda a reducir las barreras de acceso al mercado.
Recientemente, se realizó una encuesta a 1.500 profesionales de compañías farmacéuticas en la que se les preguntó cuáles son los principales motivos por los que llevaban a cabo estudios observacionales, y éstas fueron las principales respuestas (en %):
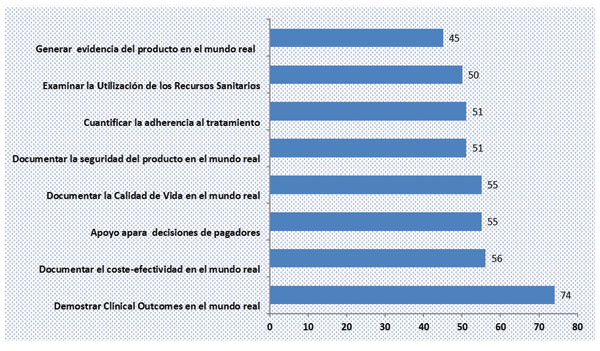
Fuente: PharmaNet/i3´s Survey on Observational Research.
RWD y Market Access
Así como RWD con respecto a seguridad es un aspecto de índole global, y cuyas acciones son lideradas por los headquarters de las compañías farmacéuticas, no se puede decir lo mismo con respecto a estrategias de Market Access, las cuales son muy marcadas por situaciones a nivel de cada país, ya que de un país a otro hay diferencias en la capacidad de aplicar RWD a la toma de decisiones en el ámbito de la Salud. Así por ejemplo las Autoridades de Precio y Reembolso italianas, dictan que todos los pacientes a los que les sean prescrito productos de un determinado precio, como medicamentos para el cáncer, deben entrar en un registro, gestionado por la compañía y por el Sistema de Salud, para que el producto sea reembolsado. El pago al fabricante se realiza solo si se ven datos positivos en los citados registros. Esto es específico de Italia, y diferente de otros países, en los que se toman decisiones de financiación diferentes.
Los financiadores de servicios de Salud demandan cada vez más y más datos del mundo real, más allá de los ensayos clínicos, ya que necesitan confirmar que el producto que inicialmente se aprobó para comercialización sigue dando buenos resultados en el mundo real a lo largo de su ciclo de vida. Están demandando entonces Real World Data. Estos datos están referidos, sobre todo, a estos tres aspectos:
1) Clinical Outcomes (eficacia y seguridad).
2) Uso de Recursos sanitarios.
3) PROs (Patient Reported Outcomes): experiencias del paciente, preferencias de tratamiento y cumplimiento.
En algunas compañías el tema del RWD se ve desde la óptica más restrictiva, en el sentido de que se genera RWD sólo si es obligatorio reportar datos, que normalmente son de seguridad, con el objetivo de cumplir los requisitos de farmacovigilancia. En otras compañías, esta visión es más amplia y se ve la generación de RWD como una oportunidad para manejar las barreras de acceso.
Hace poco se ha realizado un estudio1 utilizando 100 casos reales. En el citado estudio se observó que el RWD generado por las compañías farmacéuticas influyó en el 25% de las decisiones tomadas por payers en el área de Salud, poniendo de manifiesto que dichas decisiones no son tan dominadas por los financiadores como se piensa y que hay cabida, pues, para las evidencias provenientes de las compañías.
¿Cuáles son las fuentes principales para la obtención del RWD? Se podrían resumir en las siguientes:
* Estudios Observacionales.
* Estudios retrospectivos: este tipo de información está ya disponible y es fácil de usar.
* Patient Reported Outcomes (PROs), que pueden ser recogidos a través de paneles de pacientes.
* Encuestas de salud dirigidas a población general, como por ejemplo la National Health & Wellness Survey, llevada a cabo de forma anual en varios países, incluyendo a España y cubriendo más de 160 enfermedades.
* Datos de pacientes recogidos por los profesionales médicos (de forma prospectiva o retrospectiva).
Merece la pena detenerse en el área de los PROs. Los PROs proveen una visión más completa de la efectividad de los tratamientos y son analizados por varias razones principales: 1) Experiencias subjetivas, como por ejemplo el dolor, pueden no son registradas correctamente por el médico. 2) La información obtenida de los PROs puede ayudar a la diferenciación del producto. 3) Los PROs son cada vez más demandados por los decisores de Salud, ya que ofrecen una visión completa, no solo de la efectividad de los tratamientos, sino también de otras variables, como son: 1) el impacto de enfermedad en la productividad. 2) la carga para los cuidadores de enfermos, y 3) una perspectiva amplia sobre la calidad de vida del paciente.
Asímismo, se puede obtener información directamente del paciente en relación a:
*Adherencia al tratamiento.
* Uso de recursos sanitarios.
Los PROs son cada vez más el centro de interés de los Payers
Los PROs han ido evolucionando y están siendo cada vez más rigurosos, ya que cada vez son más psicométricos y científicos en evaluar la experiencia del paciente. Esto ha llevado a poner más el foco en lo que se ha de medir, cómo se relaciona con la manera en la que se espera que funcione un tratamiento y qué “claims” la medida del PRO apoya.
El punto de partida en cualquier estrategia de PROs es el instrumento o cuestionario que se utilice, ya que los resultados, dependen en gran medida de la recolección de los datos. Existen numerosos cuestionarios e instrumentos validados, disponibles ya para su uso, pero para nuevas medicaciones o nueva dosificación o tecnología, puede ser recomendable desarrollar nuevos instrumentos “ad-hoc”.
Otro aspecto importante a destacar es la forma de acceder a los pacientes: dado el incremento de los niveles de interconectividad es conveniente tener en cuenta nuevas formas de recoger “la voz del paciente” a través de metodologías basadas en web o dispositivos móviles. Ambas metodologías son cómodas, rápidas y sencillas.
Adherencia al tratamiento en el mundo real
Según la Organización Mundial de la Salud, “la adherencia es el grado en que la conducta del paciente, en relación con la toma de medicación, el seguimiento de una dieta, modificación de hábitos de vida, coincide con las recomendaciones dadas”.
La falta de adherencia a los tratamientos provoca cerca de 200.000 muertes en Europa al año. En España, el no seguimiento de las indicaciones terapéuticas ocasiona cerca de 20.000 muertes al año, lo que hace demandar a los profesionales una mayor “sensibilización” sobre este problema de salud pública.
Está calculado: la falta de adherencia a los tratamientos farmacológicos cuesta al Sistema Nacional de Salud español unos 11.000 millones de euros al año. La adherencia, es consecuentemente, un concepto que cada vez más interesa a los decisores de salud.
Hay evidencias de que una falta de adherencia repercute en aumento de morbimortalidad: En pacientes diabéticos, por ejemplo, con enfermedad coronaria se vio que la tasa de mortalidad era de 12,1% en los pacientes que no se adherían y de 6,7% en los que sí lo hacían.
Siguiendo con las enfermedades cardiovasculares hay estudios que han demostrado que pacientes, con enfermedad cardiovascular después de un alta hospitalaria por infarto agudo de miocardio, tienen un mayor riesgo de muerte tras haber transcurrido un año desde su alta cuanto menos adherencia al tratamiento tengan:
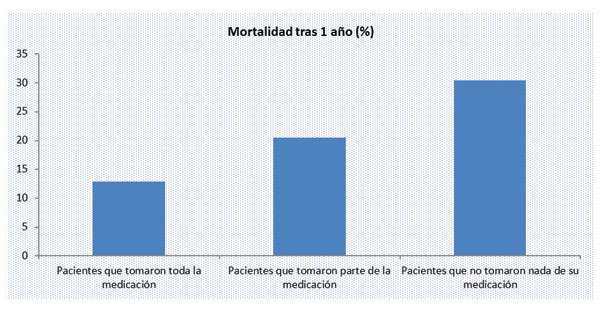
Jackevicius CA, Li P, Tu JV. Prevalence, predictors, and outcomes of primary nonadherence after acute myocardial infarction. Circulation. 2008;117:1028 –1036.
Asímismo, se ha visto que los enfermos con esclerosis múltiple (EM) que no alcanzan un cierto umbral de adherencia terapéutica tienen un mayor riesgo de padecer brotes y requerir tanto ingresos hospitalarios como visitas a urgencias, lo que se traduce en un mayor gasto sanitario. De los enfermos con EM, abandonan el tratamiento entre un 19 y un 39% en los tres primeros años de tratamiento. De éstos, entre un 10 y un 20% lo hacen en los primeros 6 meses. En los ensayos clínicos (EECC) las cifras de discontinuación se encuentran entre el 8 y el 15%. Esta diferencia en los niveles de adherencia entre los EECC y la práctica clínica habitual, se debe a que en los EECC los pacientes reciben un mayor seguimiento, cosa que no ocurre en el mundo real.
Para los Departamentos de Market Access de las compañías farmacéuticas, puede ser interesante, conocer qué nivel de adherencia, en el mundo real, presentan los pacientes tratados con una medicación concreta, midiendo así el uso de recursos sanitarios y traduciéndolo en costes. Habría posiblemente una correlación directa entre la no-adherencia y el uso de recursos sanitarios.
Presente y futuro del RWD
Actualmente, en el área de RWD estamos en un período de prueba y error: el entorno del RWD está evolucionando rápidamente y todo el mundo quiere saber qué funciona y qué no. No hay una “receta mágica” sobre cómo generar las mejores estrategias de RWD, ya que cada Compañía es diferente a otra en cuanto a prioridades, capacidades, portfolio, cultura y estructura organizacional. La forma de pensar que hasta ahora ha sido la establecida está siendo puesta a prueba de forma constante. El RWD es un área importante donde la industria farmacéutica y Administración deberían ponerse de acuerdo para mantener la transparencia y la integridad de la investigación en el mundo real.
Las compañías farmacéuticas tienen un gran camino por recorrer en RWD. La era de la medicina en el mundo real está evolucionando muy deprisa y no hay mejor momento que el presente para involucrarse en RWD, tanto internamente como dentro del contexto de nuestro entorno sanitario.
1 (May 2013). RWE Market Impacto n Medicines: A Lens for Pharma. IMS Health.




















