Históricamente las enfermedades raras (ER) han sido un asunto pendiente de la investigación clínica, tanto en el sector farmacéutico como en el ámbito público. La baja prevalencia, la escasez de datos y registros fiables y los altos costes de la investigación hacen que la investigación clínica en estas enfermedades sea complicada. Si bien es cierto que en los últimos años se aprecia un repunte de la atención y los recursos dedicados a las ER y la generación de nuevos medicamentos huérfanos.
Las ER se definen como aquellas patologías que se presentan con una prevalencia inferior a 5 casos por cada 10.000 habitantes. Esta baja prevalencia, unida a otras consideraciones como la falta de información fiable de los registros existentes, o la complejidad propia de estas enfermedades configuran un panorama muy retador. No sólo para la industria farmacéutica, que deberá invertir entre 250 y 500 millones de dólares y dedicar una media de 12 años para desarrollar un fármaco para estas patologías. Sino también para los sistemas públicos de salud, tradicionalmente enfocados en el manejo y tratamiento de patologías de alta prevalencia.
En este complicado ambiente, la investigación clínica en las ER ha sido tradicionalmente baja. Debemos tener en cuenta que las condiciones para el desarrollo de un ensayo clínico (EC) no son fáciles, ni siquiera para las enfermedades bien conocidas y con datos perfectamente fiables. En el caso de las ER, por ejemplo, existe un evidente problema para determinar la prevalencia real de la enfermedad ya que en un gran número de casos ésta no se detecta hasta los 2-5 años de vida, en la adolescencia o la adultez incluso. Por lo tanto, se hace necesario hacer seguimientos desde el nacimiento. Todo esto sumado a las muertes prematuras cuya verdadera causa es una ER no diagnosticada, y que por lo tanto no son computadas a efectos de prevalencia.
Si realizamos un análisis de las figuras principales que intervienen en un EC (el promotor, persona física o jurídica que realiza el ensayo; el investigador principal; los pacientes del ensayo clínico; y el producto estudiado en el EC) apreciamos dificultades en muchas de ellas.
Para el promotor, normalmente la industria farmacéutica, los costes asociados al EC, la dificultad en la obtención de permisos y autorizaciones para la puesta en marcha del EC y la dificultad para obtener un retorno hacen de los EC en ER un asunto espinoso.
En el caso de los pacientes de los EECC, el hecho diferenciador en las ER es el limitado número de pacientes que podemos encontrar. Esto dificulta enormemente que el reclutamiento del EC sea aceptable y complica los siguientes pasos del fármaco como pueden ser su autorización o fabricación.
Sin embargo, teniendo un panorama tan complejo sobre la mesa se observan algunas luces a través del túnel. Una de ellas, que llama poderosamente la atención, es el efecto llamado “la paradoja de la rareza”. Y es que, ciertamente, el número de personas afectadas en cada una de estas enfermedades es considerablemente menor al número de personas afectas por enfermedades de alta prevalencia. Sin embargo debido a la gran cantidad de enfermedades raras identificadas (se cree que existen entre 5 y 8 mil) se observa que un porcentaje muy considerable de la población está afectado por una ER. Tan sólo en la Unión Europea existen alrededor de 30 millones de afectados, lo que supone entre el 6 y 8% de la población. En España la cifra de afectados rondaría los 3 millones.
Esta “paradoja de la rareza” ha captado la atención de la industria farmacéutica y de las instituciones públicas, que, siendo conscientes de las complejidades y limitaciones de este nicho de mercado, comienzan a dedicar recursos humanos y materiales a las ER.
Sirva como ejemplo el avance de la legislación que dan a las ER ciertas singularidades. Por ejemplo, respecto al bajo número de pacientes que pueden ser reclutados, la normativa de la Unión Europea y la española, autorizan fármacos para ER con ciertas reservas, aunque éstos dispongan de bajo número de pacientes, y pudiéndose adoptar medidas especiales en relación con su fabricación, régimen económico, fiscal, de distribución y dispensación.
Otro ejemplo es el número de EECC que actualmente se están desarrollando en patologías conocidas como raras. En una búsqueda simple en clinicaltrials.gov se pueden encontrar 619 EECC de enfermedades raras. En la web de National Institute of Health hay numerosísimos EECC registrados, de los que en su mayoría son relativos al cáncer, pero para ER se distinguen al menos 160 en este momento.
Es lógico pensar que si existe un aumento en el número de EECC lo habrá igualmente en el número de fármacos comercializados, o al menos, en el número de designaciones de medicamentos huérfanos. Y así es. Las gráficas 1, 2, 3 y 4 demuestran una tendencia al alza, tanto de las designaciones por parte de la EMA (European Medicines Agency) y la FDA (Food and Drug Administration) de medicamentos huérfanos como en las autorizaciones de comercialización de estos fármacos.
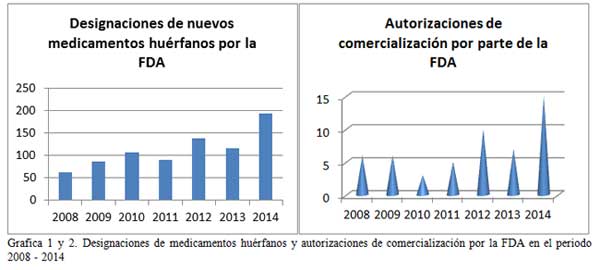
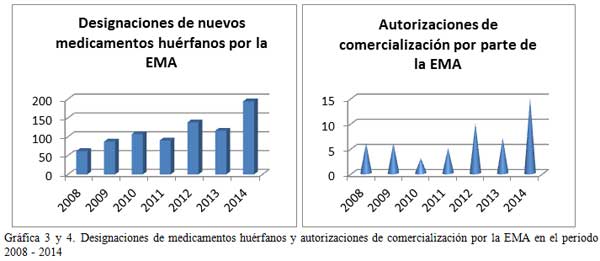
 El listado completo de medicamentos para enfermedades raras puede ser consultado en www.orpha.net siendo este listado actualizado periódicamente. El listado contiene la actualización completa de los medicamentos con autorización de comercialización en Europa, detallando nombre comercial, sustancia activa y compañía comercializadora.
El listado completo de medicamentos para enfermedades raras puede ser consultado en www.orpha.net siendo este listado actualizado periódicamente. El listado contiene la actualización completa de los medicamentos con autorización de comercialización en Europa, detallando nombre comercial, sustancia activa y compañía comercializadora.
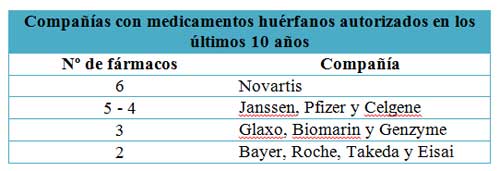
Merece la pena comentar que este repunte en la aparición de nuevos medicamentos para ER está sustentado en su mayor parte por empresas de mediano a pequeño tamaño, encabezadas en su mayor parte por empresas biotecnológicas, en la mayoría de las ocasiones, operando de forma monoproducto. Haciendo esta salvedad, otro dato ilustrativo es el número de empresas que tienen algún medicamento huérfano autorizado, ranking que sí lideran las grandes farmacéuticas.
Otro de los aspectos que han avanzado en estos años, y que da esperanzas para una mayor y mejor investigación clínica en ER es el desarrollo de registros y estudios observacionales. Las dificultades comentadas al respecto de los EECC hacen de esta alternativa una vía para el desarrollo de nuevos conocimientos y evidencia científica y clínica sobre las ER.
Siguiendo esta línea de trabajo, se han desarrollado numerosos registros de pacientes. Una herramienta esencial en el campo de la investigación clínica de ER. Ya que, como se ha mencionado, la falta de información verídica sobre la prevalencia de las ER es uno de los principales escollos para la investigación clínica en este área. Adicionalmente permiten un fácil reclutamiento de pacientes una vez surgen opciones terapéuticas a las que pudieran acogerse.
Como resumen, dada la visibilidad que están adquiriendo las ER, el número de EECC dedicados a estas patologías, el número al alza de medicamentos destinados a estas enfermedades y el avance imparable de la ciencia y la tecnología que permite poner a disposición de estos pacientes cada vez más y mejores tratamientos, los autores de este artículo creemos que en esta situación se puede concluir que la falta de investigación clínica en las ER ha quedado atrás. Desde nuestro punto de vista el cuello de botella ya no se encuentra tanto en los recursos dedicados por la industria farmacéutica, que cada vez es mayor, sino en la consecución de una normativa más favorable y el entendimiento entre industria, investigadores, pacientes y ámbito público.

















 El listado completo de medicamentos para enfermedades raras puede ser consultado en
El listado completo de medicamentos para enfermedades raras puede ser consultado en 


