La propiedad intelectual (PI) juega un papel fundamental en la protección y desarrollo de la innovación, a la vez que plantea desafíos en términos de acceso a medicamentos y competencia en el mercado. Cómo un laboratorio gestione su PI va a determinar enormemente su cuenta de resultados, ya sea un innovador o un laboratorio de genéricos.

No, las patentes de los medicamentos no duran 10 años. Haber escuchado tantas veces la afirmación de esa idea, incluso desde escuelas de negocios farma, es la principal razón para este artículo, junto a la importancia que tiene la propiedad intelectual en la rentabilidad de un medicamento a lo largo de su ciclo de vida.
Tratar un tema tan complejo como la propiedad intelectual en medicamentos de forma exhaustiva supondría cientos de páginas, por tanto, este artículo préndete solamente recopilar las ideas básicas en torno a este tema, ya que frecuentemente se confunden.
Lo primero que debemos de tener claro, es que cuando hablamos de propiedad intelectual, estamos hablando principalmente de los dos conceptos que protegen a un medicamento innovador de la salida al mercado de genéricos: las patentes y las exclusividades. Nada tienen que ver la una con la otra, simplemente coinciden en el tiempo durante años, pero son independientes. La que más lejos se vaya en el tiempo, será la que realmente otorgue protección efectiva para el innovador.
El primero de estos conceptos, las patentes, son básicamente una protección que tiene cualquier invento o innovación y que como tal novedad se registra y, si se aprueba, otorga una protección al inventor para impedir que otros fabriquen o utilicen comercialmente su invención sin su autorización. No es exclusiva de medicamentos sino que las hay en cualquier ámbito. Estas duran 20 años desde su registro. Pero el desarrollo de medicamentos es especial, a diferencia de otras industrias en donde puedes comenzar a comercializar tu invento casi de inmediato, con los medicamentos todavía hay que terminar el desarrollo (las primeras patentes se registran siempre antes de terminarlo) y luego todavía faltaría todo el proceso de registro, con lo que para cuando el laboratorio pueda empezar a comercializar, ya habrá consumido varios años de su patente. Por tanto, en Europa se ha establecido un mecanismo adicional, llamado SPC (del inglés Suplementary Protection Certificate) que permite extender la duración de la patente hasta en 5 años, por tanto, se pueden obtener hasta 25 años de protección por patente como máximo. Esto estaría ligado a que haya un máximo de protección de mercado eficaz de 15 años (entre patentes y exclusividades, siendo la única casuística en donde hay una dependencia entre las fechas de patentes y exclusividades).
El desarrollo de un medicamento implica muchos “inventos” o innovaciones, desde moléculas nuevas, a los procesos de síntesis química de la su producción, así como el descubrimiento de la utilidad de la molécula para una indicación concreta, etc. Por tanto, cada una esas innovaciones son susceptibles de ser patentadas, y por tanto un medicamento puede tener varias patentes, y efectivamente tienen siempre varias.
Como cada patente hace referencia a una invención concreta y no al conjunto de cualidades del producto comercial, la protección de cada una de ellas no siempre es eficaz. En algunos casos las patentes pueden esquivarse o “circunvalarse”, y esto es fruto de su propia naturaleza, ya que como decía, protegen una innovación concreta. Por ejemplo, si una patente protege una ruta de síntesis química de una molécula, algo muy habitual, es posible que se pueda lograr llegar a obtener la misma molécula mediante una ruta diferente, de forma que el desarrollador del genérico no incumple la patente y por tanto esta no está previniendo de la salida de genéricos. Hay otras patentes absolutamente restrictivas, por ejemplo, una patente de uso para un medicamento que solo tiene aprobada una indicación: si esa indicación está protegida y no hay más, el genérico no podrá utilizar ninguna indicación con la que salir al mercado.
Por tanto, es importante determinar cuales son las realmente “fuertes” y que no se pueden circunvalar.
Igualmente, como concurren en el tiempo diferentes patentes, habrá que determinar de entre las fuertes, cual es la que se va más lejos en el tiempo. Esto nos dará una primera posible fecha de protección efectiva.
Un concepto diferente son las exclusividades, estas si son un privilegio exclusivo de los medicamentos, ya que, debido al alto coste de desarrollo de un medicamento, son una manera de garantizar los 10 años de venta al mercado sin competencia para recuperar la inversión. Las exclusividades en Europa se rigen por la conocida norma del 8+2+1, esto es:
* 8 años de exclusividad de datos (ningún genérico puede presentar un dossier a registro hasta los 8 años desde la aprobación del medicamento innovador),
* +2 años de exclusividad de mercado (los genéricos se pueden presentar ya a registro, pero no lanzar al mercado, aunque hayan obtenido la aprobación),
* +1 año extra de exclusividad de mercado en el caso de que durante los 8 primeros, el laboratorio innovador obtenga la aprobación para una nueva indicación que suponga un beneficio significativo frente a terapias existentes.
A esto, hay que añadir otras posibles extensiones de exclusividad:
* extensión pediátrica, que alarga la protección de mercado en 6 meses si se llevan a cabo estudios clínicos en pacientes pediátricos (paediatric investigation plan - PIP),
* o la ODE (Orphan Drug Exclusivity), extensión de 2 años si el medicamento es designado como huérfano (si la indicación afecta a no más de 5 personas por cada 10.000 habitantes, que no haya otro tratamiento satisfactorio, etc).
En el caso de la exclusividad de mercado, por tanto, es más sencillo determinar hasta cuando protege.
Patentes y exclusividades coinciden en el tiempo durante parte de su vigencia, y será la que termine más tarde la que otorgue mayor protección (fecha de restricción o constraint date en inglés).
A diferencia de las patentes, la exclusividad de mercado es algo insalvable para un medicamento genérico, no hay forma de que pueda salir al mercado ninguno mientras esta está en vigor.
Por tanto, deben de analizarse tanto patentes como exclusividades para determinar la constraint date.
Esto se entiende mejor con el esquema de abajo, en el cual podemos ver que para una patente de un medicamento concreta, se muestran 3 posibilidades de fechas de aprobación del medicamento. En la primera posibilidad, la exclusividad de mercado no aporta protección efectiva, ya que durante esos años la patente también está en vigor, de forma que sin exclusividad el medicamento tendría la misma protección. En la tercera posibilidad la situación es la inversa, la exclusividad de mercado va a otorgar una protección más tardía, independientemente de si la patente tiene o no SPC.
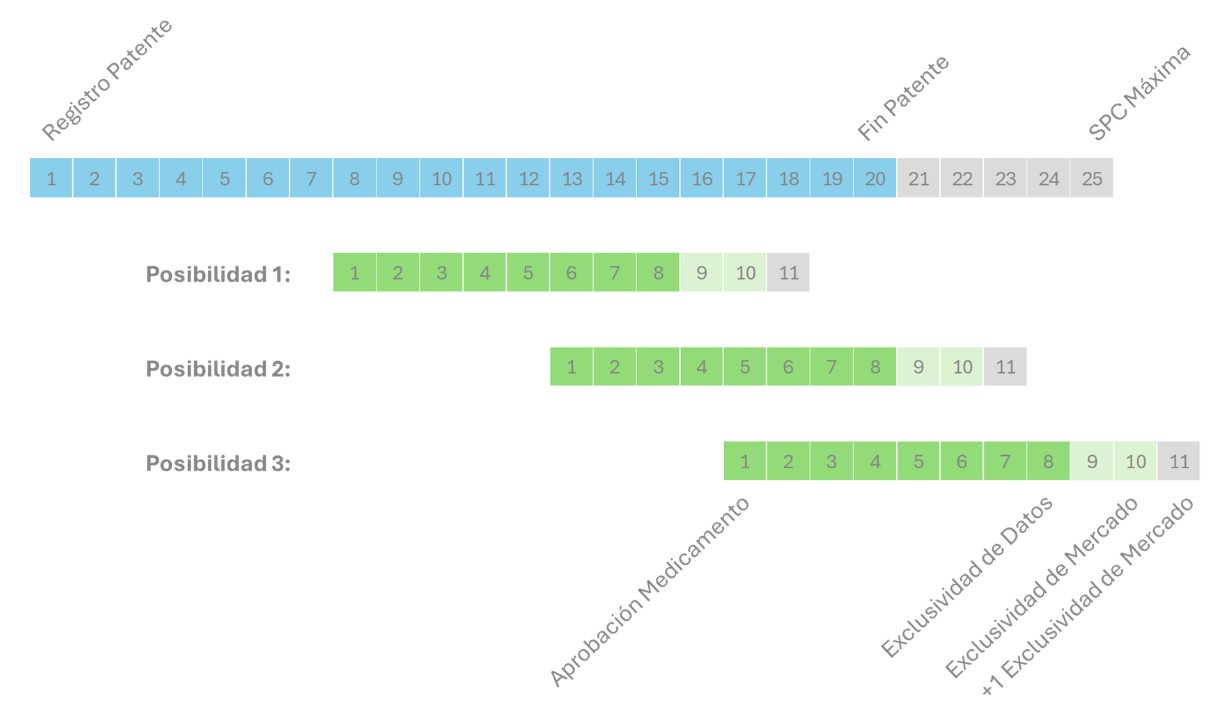
Todo esto tiene implicaciones enormes en cuanto a la rentabilización de los desarrollos, tanto de los medicamentos innovadores como de los genéricos. Así, un laboratorio de innovación debería de tratar de extender al máximo posible las diferentes exclusividades a las que puede optar, a la vez que puede añadir protección por patentes adicionales, y esto requiere una estrategia global orquestada idealmente desde I+D y departamento médico. Alargar medio año o un año la vida bajo protección de mercado de un innovador, en todo el mundo o solo en Europa, puede representar cientos de millones de euros.
Igualmente, un laboratorio de genéricos con presencia global, debería de realizar una estrategia de desarrollo de portfolio considerando las patentes y exclusividades de forma global, de esta forma puede rentabilizar sus desarrollos en más mercados, a la par que lograr un retorno de la inversión mucho más temprano si incluye mercados más lejanos, como el norteamericano, en donde se suelen lanzar antes los medicamentos innovadores que en Europa, y además cuentan con una exclusividad por molécula nueva de solo 5 años, por lo que el genérico allí se puede lanzar habitualmente varios años antes que en Europa. Quien sepa jugar a esto, jugará en primera división, ya que es un mercado mucho más grande que el europeo, y al que tienes que llegar mucho antes, de forma que para cuando lances en Europa tu cuenta de resultados de la molécula ya estará en positivo (y seguramente de largo). Por el contrario, si desarrollas de acuerdo a los tiempos europeos, para cuando tengas tu desarrollo listo, los mercados extracomunitarios estarán ya copados de licencias concedidas por laboratorios que han desarrollado para EEUU.
Europa es la región del mundo con mayor protección de PI para medicamentos, ya que la protección por exclusividad de mercado no está extendida por el mundo, como si lo están las patentes, y los territorios que si la tienen, ninguno ofrece 10 años de base como Europa. Además, se pueden llegar a otorgar hasta 5 años extra de SPC como comentaba antes. Esto hace de Europa la región con mayor duración de la protección, y explica porque una compañía de genéricos europea debería de empezar a rentabilizar sus desarrollos en otros territorios antes que en Europa, y explica también porque una compañía innovadora no europea debería de prestar un poco más de atención a Europa en su estrategia de protección, ya que aunque el mercado sea más pequeño que el americano, se puede extender mucho más tiempo la protección.
Por último, cabe destacar que los tiempos de las exclusividades a Orphan Drugs son más protectores, como es lógico, siendo este el esquema general:
* 10 años de Exclusividad de datos y de mercado
* +1 posible año adicional
* +2 años extra de EM por estudios en pediatría (paediatric investigation plan – PIP)




















