"Effective communication is the ultimate, but often daunting, aim of any piece of medical research or clinical study".
Goodman NW and Edwards MB. Medical Writing: a Prescription for Clarity. 1997. Cambridge University Press.
Dos elementos importantes en la estrategia reguladora pero también comercial de un producto farmacológico son el programa de desarrollo clínico así como la comunicación de los datos generados en este programa de ensayos clínicos. De hecho, el Comisario Europeo de Ciencia e Investigación, Janez Potocnick, ya comentó en 2005 en el marco de una conferencia sobre "Comunicar la investigación en la UE" realizada en España que "la investigación es más que una prioridad; es una obligación: igual que lo es saber transmitirla a la población de la forma adecuada". Sin embargo, dada la inversión realizada para desarrollar un producto, una compañía farmacéutica no puede dejar la comunicación de los datos al azar. Se necesita una planificación estratégica que comience temprano (en la fase preclínica o en la fase I de ensayos clínicos), que se adapte a la fase de vida del producto, que sea extensa y consistente, que facilite una extensión de valor mediante los datos, que use vehículos múltiples para diseminar dichos datos y que apoye el posicionamiento del producto. Por lo tanto, un Plan de Publicación Estratégico es un elemento clave para la coordinación exitosa de un lanzamiento de producto.
¿Qué es un Plan de Publicación Estratégico? Es un proceso multitarea que resulta en una adecuada y oportuna presentación de los datos obtenidos en diferentes estudios así como de los argumentos de soporte hallados en la literatura peer-review mediante la publicación de abstracts (en congresos), artículos primarios y secundarios, revisiones y otros ítems editoriales (cartas al editor, suplementos de revistas, etc.) (Figura 1).

El objetivo global de este tipo de plan es facilitar información a los organismos decisores y a los prescriptores sobre el nuevo fármaco/indicación en las diferentes fases de tomas de decisión respecto a dicha innovación terapéutica (especialmente durante las primeras fases de vida del producto). Los objetivos generales son acelerar el tiempo de publicación de los estudios, maximizar la frecuencia de citación y alcance de los datos en la comunidad médica, apoyar la plataforma de posicionamiento y ventas (el plan de publicación tiene que estar coordinado con el plan de marketing general), facilitar fuentes autorizadas para las comunicaciones de marketing y otros materiales promocionales, y ayudar a acelerar la adopción de un nuevo principio activo o indicación.
El Plan de Marketing Estratégico (PME) es el punto de referencia (navigational benchmark) con respecto a los mensajes clave a difundir en el Plan de Publicación Estratégico: conocimiento del producto, eficacia, seguridad, diferenciación, coste, etc. El PME facilita el desarrollo e implementación del Plan de Publicación. Los elementos principales del PME a tener cuenta son los documentos de posicionamiento, el análisis SWOT (strenghts, weaknesses, opportunities and threats) y los objetivos estratégicos. Es adecuada la complementación con el Plan de Comunicación, el cual incluirá los Advisory Boards, los investigadores/líderes de opinión clave, el Plan de Formación/Educación Médica y las iniciativas de relaciones públicas.
El Plan de Publicación puede dividirse en tres fases principales (Figura 2).
La primera fase consiste principalmente en decidir el diseño (Figura 3) y la planificación global del Plan de Publicación. En este punto se tiene que hacer un análisis de la bibliografía del producto y ver que ha sido publicado, asignar mensajes clave a las publicaciones existentes y delinear los mensajes clave ya comunicados previamente. Paralelamente se hará un análisis de los productos competidores: ¿Cuáles son los competidores clave? ¿Qué mensajes clave comunican? y sus publicaciones: tipo, fuente (revista/meeting), autores, etc.
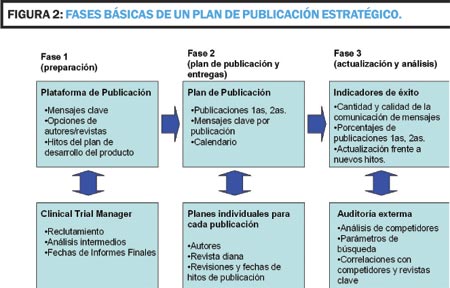
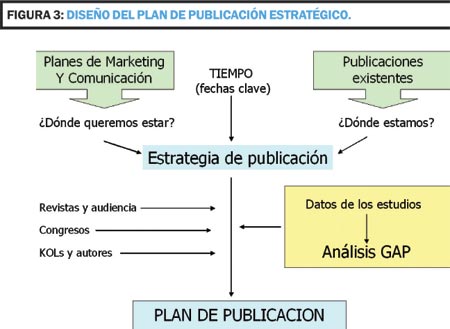
Asimismo se han de analizar los estudios existentes en el plan de desarrollo preclínico y clínico. Se ha de realizar un análisis GAP (Gather, Assess and Prioritize), esto es, reunir, evaluar y priorizar la documentación existente sobre los estudios aún no publicados. Dicha documentación consiste en Protocolos e Informes Clínicos, Manuales del Investigador, el Plan de Desarrollo Preclínico y Clínico y las presentaciones en Congresos. Algunas fechas clave a tener en cuenta son la fecha de lanzamiento del producto, las fechas clave del proceso regulador,.la fecha de disposición de cada informe clínico y las fechas de congresos clave. Asimismo se ha de prever el tiempo para generar los diferentes entregables: primer borrador de cada manuscrito y posteriores revisiones. En esta fase se han de definir los parámetros principales: mensajes clave por publicación y priorización de estudios (se han de priorizar los estudios que mejor apoyen los mensajes clave pero hay que evitar el sesgo de publicación, esto es, no publicar resultados negativos; los vehículos de publicación (artículo original, revisión, suplementos); la audiencia diana (revistas y congresos) y los tiempos. En este caso, una revisión bibliográfica exhaustiva nos permitirá conocer el perfil de publicación del área, definir las revistas de mayor interés por número de artículos publicados, factores de impacto, etc.
La segunda fase es de ejecución del Plan y de monitorización del mismo. El Plan de Publicación define la táctica de publicación individual para cada estudio que asegura el seguimiento de la estrategia global. La monitorización a corto plazo evalúa el estado de los estudios (aquellos completados según protocolo, los que han tenido cierres prematuros, etc.), el estado de las publicaciones (revisiones, aceptaciones, rechazos editoriales), las sumisiones de abstracts en congresos y posibles sugerencias para nuevos manuscritos o revisiones. La monitorización a largo plazo incluye aspectos de proactividad y reactividad (puede implicar reconsiderar la estrategia), el refinamiento de los mensaje clave, la monitorización de los competidores, la evaluación de datos y rean por número de artículos publicados, factores de impacto, etc.
La segunda fase es de ejecución del Plan y de monitorización del mismo. El Plan de Publicación define la táctica de publicación individual para cada estudio que asegura el seguimiento de la estrategia global. La monitorización a corto plazo evalúa el estado de los estudios (aquellos completados según protocolo, los que han tenido cierres prematuros, etc.), el estado de las publicaciones (revisiones, aceptaciones, rechazos editoriales), las sumisiones de abstracts en congresos y posibles sugerencias para nuevos manuscritos o revisiones. La monitorización a largo plazo incluye aspectos de proactividad y reactividad (puede implicar reconsiderar la estrategia), el refinamiento de los mensaje clave, la monitorización de los competidores, la evaluación de datos y reanálisis y un análisis GAP continuo para una posible reevaluación de prioridades.
Para tener éxito, el Plan de Publicación Estratégico ha de tener una continua y estrecha supervisión, unos objetivos claramente definidos, recursos suficientes y responsabilidades claramente definidas. El Plan de Publicación Estratégico es un proceso complejo y con múltiples facetas que depende de diversos grupos. Por ello se requiere un equipo interdisciplinario (Equipo del Plan de Publicación) dedicado a seguir el progreso del plan, solucionar los conflictos organizativos y planificar las necesidades futuras. El equipo de proyecto debería incluir representantes activos de Marketing/Medical Marketing/Medical Affairs, I + D (Preclínico y Clínico), Asuntos Regulatorios, Medical Writing, Investigadores/Líderes de Opinión (autores), Project Management, Health Economics y otros si fuera preciso. En general, las responsabilidades principales de este equipo de proyecto son: 1) integrar el Plan de Publicación con los procesos de I+D de la compañía; 2) desarrollar PNTs para implementar el Plan (o sea, establecer la política de publicación); 3) determinar el presupuesto y los recursos humanos necesarios, incluyendo presentaciones y eventos de Formación Médica Continuada (con una reevaluación anual preferiblemente); 4) identificar y priorizar datos para su publicación y presentación; 5) desarrollar y coordinar el calendario de publicaciones con los diferentes departamentos de la compañía implicados y con los autores; 6) desarrollar un mix de comunicación científica específico y apropiado para cada fase de desarrollo del producto; 7) reexaminar prioridades a medida que aparezca nueva información, y 8) evaluar la tasa de éxito del Plan. Con el objetivo de centralizar toda esta información, muchas compañías están implementado una nueva figura laboral denominada de formas diferentes (siendo Publication Manager la más habitual) pero con una función común: supervisar todas las actividades relacionadas con este tipo de planes.
La tercera y última fase es la de análisis mediante indicadores de éxito del plan así como la de actualización según nuevos hitos o modificaciones halladas en las publicaciones de productos competidores. Esta fase es probablemente la más complicada de llevar a cabo dada la falta de uniformidad en los criterios usados para evaluar el éxito del plan según cada compañía: no hay métricas estándar en la Industria Farmacéutica. En principio, el éxito de un Plan de Publicación debería ser medido por el cumplimiento de los objetivos establecidos durante la fase de diseño del mismo. Por supuesto, desviaciones tales como datos no entregados, cambios en la estrategia de productos competidores, las relaciones con los investigadores así como otras múltiples distracciones que aparecen por el camino hacen que alcanzar estos objetivos pueda constituir todo un reto. ¿Cómo podemos medir el éxito del Plan de Publicación Estratégico? En este punto es importante considerar valoraciones objetivas usando técnicas métricas. Dicha métrica de publicación puede ser basada en la cantidad o basada en la calidad.
La métrica basada en la cantidad incluye evaluaciones numéricas tales como número de publicaciones totales, número de publicaciones primarias y secundarias, número de publicaciones frente a competidores, número de sumisiones realizadas a revistas frente a número de aceptaciones, número de comunicaciones a congresos, o número de hitos frente a una audiencia determinada (por Área Terapéutica o por especialidad, por ejemplo)..
La métrica basada en la calidad es más compleja ya que ha de determinar la calidad de las publicaciones en términos de cómo se han presentado los datos así como el impacto que han tenido sobre la comunidad médica de interés: por ejemplo, número de veces que dichos datos son referenciados por artículos posteriores y la calidad de la correspondencia con la revista relacionada con el artículo en los meses posteriores a la publicación. Esta métrica basada en la calidad necesita imperativamente un análisis bibliométrica y el uso de bases de datos especializadas (no sirve el uso de PubMed, por ejemplo). La fuente de datos más común para el análisis bibliométrico en el área biomédica ha sido durante años la base de datos "Science Citation Index" (SCI) producida por Thomson Scientific (ahora incluida en la Web of Knowledge; http://www.isiwebofknowledge.com). Esta es una base de datos documental y retrospectiva donde se recogen todas las contribuciones (artículos, editoriales, cartas, revisiones, etc.) que se publican en las revistas de ciencia y tecnología indexadas por Thomson Scientific. A este índice de citación también se le conoce como ISI ya que en un principio la institución que producía el índice era el Institute for Scientific Information (ISI) fundado por Eugene Garfield en 1960. Esta base de datos permite identificar el número de publicaciones por año pero también el número de citaciones por año, qué artículos son citados, en que revistas y por que autores de que países o instituciones o la media individual de citas para cada artículo (Figura 4).
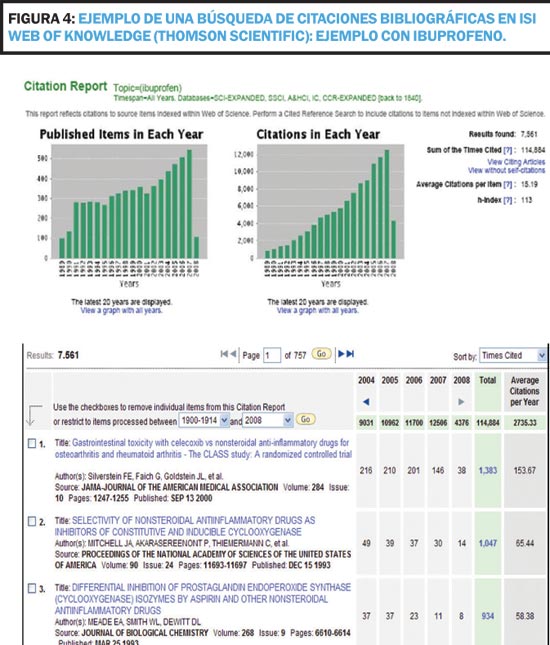
Otro dato de interés que se pueden obtener es el índice de Hirsch (índice h). El índice h es el valor promedio de dos datos relevantes: citaciones y número de trabajos (Figura 5). Por ejemplo, un factor h=113 como el mostrado en la Figura 4 significa que la molécula de ibuprofeno tiene en promedio 113 artículos que han sido citados 113 o más veces. Categorizar la productividad científica con el factor h presenta varias ventajas: es un promedio de citación extendido a lo largo de los años, permite extrapolar el rendimiento de un investigador o producto a medio plazo, y sobre todo es muy robusto ante las manipulaciones (es un número que sólo puede crecer o permanecer estancado),. La reciente introducción de los nuevos métodos de análisis del Thomson Web of Knowledge permite que el cálculo del número h sea casi inmediato, lo que contribuye a que su uso sea enormemente atractivo para evaluar las citas de artículos de un Plan de Publicación. Un reflejo claro de impacto en la comunidad médica sería evaluar si el índice h de las publicaciones del producto de interés va aumentando conforme se desarrolla el Plan de Publicación. Este índice de Hirsch ha sido incluido también por otras bases de datos bibliométricas como Scopus (www. scopus.com) y muestra un prometedor futuro en el campo de la métrica de publicación.

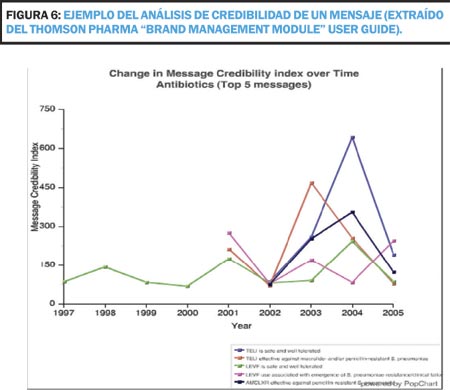
No obstante, un defecto de las bases de datos mencionadas anteriormente para el propósito de un Plan de Publicación es que no permiten identificar si las citas han sido realizadas en un contexto de valoración positiva o negativa. Desde 2006 existe otra herramientas más específica (Thomson Pharma "Brand Management Module") que permite análisis métricos de tipo gráfico y estadístico basados en la evidencia hallada en las publicaciones. Con ella se pueden evaluar índices de interés como el de Fuerza de los Mensajes, Credibilidad de un Mensaje, Mensajes Positivos o Negativos publicados, etc. (Figura 6).
En conclusión, el objetivo principal de un Plan de Publicación exitoso es facilitar la comunicación de los hallazgos clave que sean relevantes y de uso práctico para el profesional médico. Existen diferentes métodos para medir el éxito de un Plan de Publicación pero las tendencias actuales apuntan a un desplazamiento desde la métrica relacionada con el volumen o cantidad a la métrica basada en la calidad. El uso de la métrica en Planes de Publicación está evolucionando rápidamente como responsabilidad de un proceso que implica diferentes departamentos. Muchos responsables de comunicación del producto han sido incentivados en el pasado con métricas tales como el número de publicaciones anuales o la calidad de las revistas donde se publican los trabajos (medida por factores de impacto). Sin embargo, la tendencia actual revela el uso más extendido de métricas más sofisticadas tales como la calidad de los manuscritos en términos de cómo se presentan los datos, el número de veces que dichos datos son referenciados por artículos posteriores y la calidad de la correspondencia con la revista relacionada con el artículo en los meses posteriores a la publicación. No obstante, la medida de datos de cantidad sigue siendo relevante en muchos planes. No hay métricas estándar en la industria y se usan diferentes métricas cuantitativas, tales como medir el número de manuscritos sometidos frente al número de artículos publicado o el número de abstracts sometido frente al número de abstracts aceptado en congresos.






















