Se han explorado los mecanismos de la memoria inmune innata (inmunidad entrenada, TRIM por sus siglas en inglés) durante las últimas décadas, aunque en gran medida permanecen desconocidos. Los mecanismos implicados incluyen programas epigenéticos, transcripcionales y metabólicos tras una exposición inicial a un patógeno, una célula o una vacuna inductora de inmunidad entrenada. Constituyen un campo de desarrollo de vacunas en infecciones microbianas y en tratamientos de otras enfermedades bien por administración local, como mucosas, como por administración sistémica.
La inmunidad entrenada es un concepto inmunológico relativamente nuevo que implica que las células inmunitarias innatas adquieren características de memoria a largo plazo que influyen en las respuestas inmunitarias después de un desafío secundario. La inmunidad entrenada es importante no solo en infecciones, sino también en enfermedades caracterizadas por respuestas inmunitarias desreguladas, como enfermedades autoinmunes e inflamatorias o cáncer. Modular la inmunidad entrenada constituye un objetivo importante para la prevención y el tratamiento de estas enfermedades.
Queda mucho por descubrir de los mecanismos tras la inmunidad entrenada, cómo se induce y modula en diversas enfermedades. Aún conocemos poco sobre los efectos moduladores, de vacunas y medicamentos actualmente disponibles, en la inmunidad entrenada. Aunque la mayor parte de la información disponible es sobre la capacidad inductora de la inmunidad entrenada de algunas vacunas, especialmente de aquellas administradas a través de mucosas.
La inmunidad entrenada ha sido descrita principalmente en monocitos y macrófagos. Estas células inmunitarias innatas comparten la capacidad de reconocer y responder a un amplio repertorio de estímulos, incluyendo tanto los patrones moleculares asociados a patógenos (PAMPs) de microorganismos como los patrones moleculares asociados a daños endógenos (DAMPs).
Entre los PAMPs descritos como inductores de inmunidad entrenada, la mayoría de la investigación se ha centrado en Candida albicans y en ligandos de BCG como el β-glucano y el dipéptido de muramilo (MDP), respectivamente. Además de los patógenos fúngicos y bacterianos, otros estudios han demostrado que los monocitos pueden adquirir respuestas inmunológicas no específicas tras la exposición a muchos ligandos diferentes, incluyendo aquellos presentes en parásitos o patógenos virales.
Un resumen de la inducción de la memoria inmunológica innata sería:
Los estímulos endógenos o exógenos activan sus respectivos receptores de reconocimiento de patrones (PRRs).
Se induce una reprogramación epigenética y metabólica de las células.
Como resultado hay funciones efectoras mejoradas, como aumento de la fagocitosis, la producción de citoquinas y especies reactivas de oxígeno (ROS).
Finalmente, como resultado esta respuesta inmunitaria mejorada tiene consecuencias para el desarrollo de la protección no específica contra infecciones fúngicas, virales, bacterianas y parasitarias.
En las revisiones sobre inmunidad entrenada se ha observado que la inducción de la inmunidad entrenada tiene dos componentes principales: respuestas centrales y periféricas.
En un primer momento el estímulo inductor de la inmunidad entrenada desencadena una respuesta local aguda que implica la participación de diferentes subconjuntos de células inmunitarias innatas locales, como neutrófilos, macrófagos o células dendríticas.
Si la estimulación es lo suficientemente fuerte, también desencadenará una respuesta central en la médula ósea del individuo, induciendo una reprogramación metabólica y epigenética a largo plazo en las células madre hematopoyéticas que se transmitirá a sus células hijas, facilitando el establecimiento de respuestas de memoria inmunológica innata a largo plazo. Ciertos subconjuntos de células, que pueden renovar sus poblaciones sin la participación de progenitores hematopoyéticos, también pueden transmitir características de inmunidad entrenada a sus células hijas.
Un complejo proceso controla la inducción, regulación y mantenimiento de la inmunidad entrenada, están implicadas muchas vías, como la glucólisis, la fosforilación oxidativa, la glutaminólisis, el metabolismo del colesterol, la oxidación de ácidos grasos (AG), y el metabolismo de la metionina y el glutatión, define la disponibilidad de metabolitos cruciales para inducir y mantener los cambios epigenéticos y funcionales necesarios.
Las vacunas clásicamente inducen memoria inmunológica adaptativa a largo plazo y protección específica contra antígenos de patógenos/infecciones objetivo. Ciertas vacunas confieren protección heteróloga contra patógenos no relacionados. La inmunidad heteróloga puede explicarse por la inmunidad adaptativa cruzada humoral y celular, así como por la memoria inmunológica innata o inmunidad entrenada.
Las vacunas basadas en la inmunidad entrenada constan de dos componentes esenciales, los inductores de inmunidad entrenada, los patrones moleculares asociados a patógenos (PAMPs), que se dirigen a los receptores de reconocimiento de esos patrones y antígenos asociados a los patógenos a los que se dirige la inmunidad adaptativa.
Por ello este tipo de vacunas se caracterizan por conferir resistencia no específica a antígenos, directamente dependiente de la estimulación de la inmunidad entrenada, más una resistencia específica a antígenos dependiente de la inmunidad adaptativa contra los componentes de las vacunas basadas en inmunidad entrenada y patógenos no relacionados eventuales.
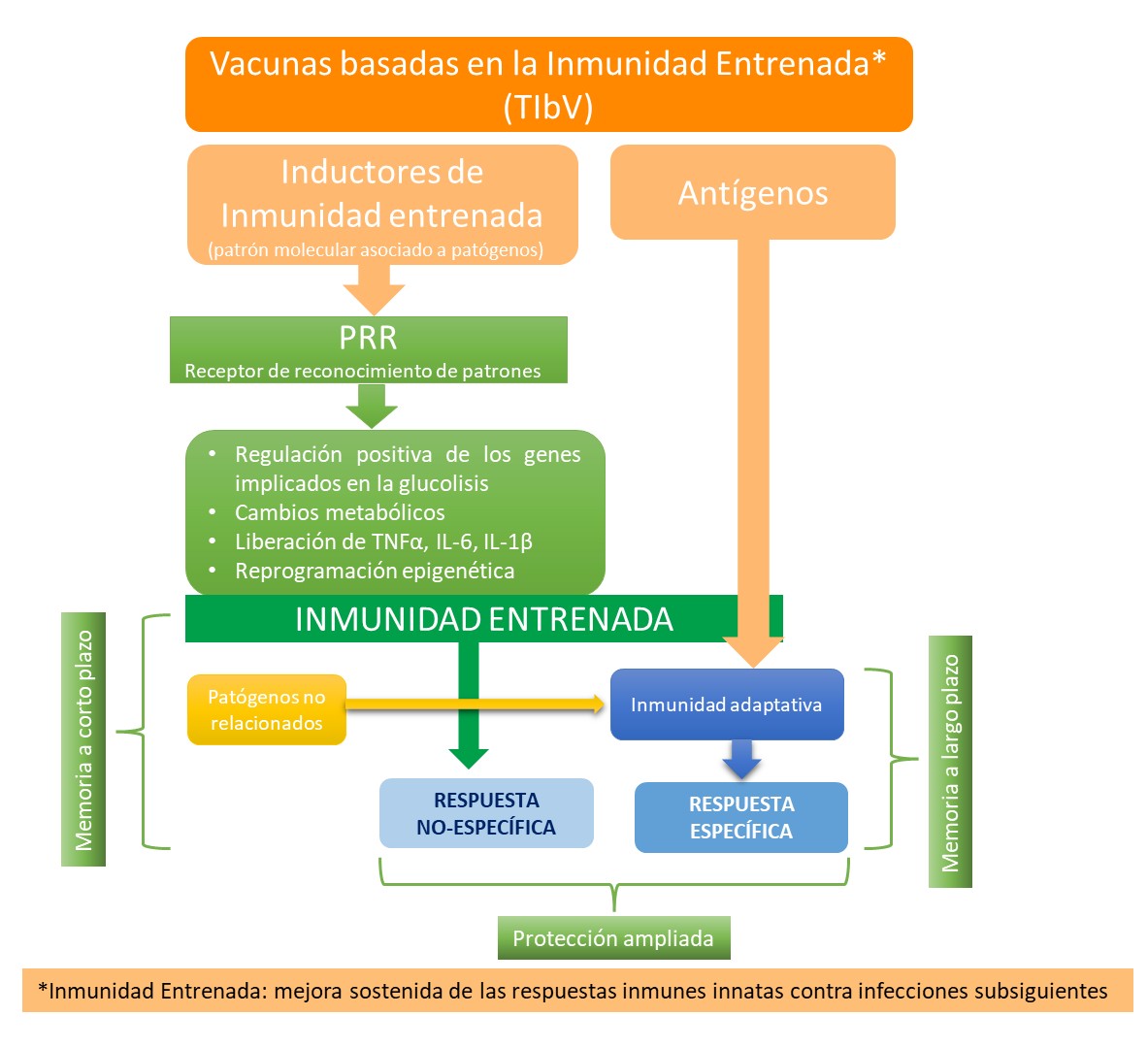
Adaptado de : Sánchez-Ramón S, Conejero L, Netea MG, Sancho D, Palomares Óand Subiza JL (2018) Trained Immunity-Based Vaccines: A New Paradigm for the Development of Broad-Spectrum Anti-infectious Formulations. Front. Immunol. 9:2936.doi: 10.3389/fimmu.2018.02936
Las vacunas basadas en inmunidad entrenada actúan sobre las células del sistema inmunitario innato, como los macrófagos/monocitos y las células dendríticas, induciendo inmunidad entrenada que, a su vez, conducirá a una resistencia no específica y a la eliminación de patógenos. Además, las células dendríticas entrenadas potencian las respuestas de células T y la diferenciación de células T helper (por ejemplo, Th1 y Th17) contra antígenos relacionados con las vacunas y antígenos no relacionados.
En el contexto de infecciones recurrentes del tracto respiratorio, urinario o ginecológico, las vacunas basadas en la inmunidad entrenada tienen el potencial de inducir un período protector que proporciona resistencia al huésped tanto contra patógenos relacionados con las vacunas como contra patógenos no relacionados, reduciendo la tasa de infección.
La incorporación de moduladores de inmunidad entrenada en las tecnologías de vacunas modernas tiene importantes implicaciones para el desarrollo de vacunas. Al emplear la memoria inmunológica innata en las formulaciones de vacunas de próxima generación, potencialmente podemos mejorar la eficacia de las vacunas contra diversas enfermedades infecciosas, lo que conduce a un mejor control y prevención de enfermedades. Este enfoque podría ser particularmente valioso en situaciones en las que las vacunas actuales han demostrado una eficacia subóptima o cuando se busca una protección más amplia, como poblaciones infantiles, ancianos, inmunocomprometidos, u otras poblaciones vulnerables.
Los esfuerzos de investigación futuros deberían dirigirse a optimizar la integración de inductores de inmunidad entrenada en las formulaciones de vacunas, entender las vías activadas y sus mecanismos de acción, y evaluar sus efectos a largo plazo en las respuestas inmunitarias.
No debemos olvidar que también debemos conocer la posibilidad de hiperactivación de células inmunitarias, por lo que debemos investigar también posibles inmunopatologías o interferencias con la memoria inmunitaria específica.
Este apasionante mundo de las vacunas basadas en la inmunidad entrenada en infecciones del tracto genitourinario es uno de los campos de investigación de Biowise Pharmaceuticals.
Conclusión
Las vacunas con características de inmunidad entrenada pueden conferir protección en grupos de alto riesgo de infección y proporcionar protección no específica contra una amplia gama de patógenos no relacionados. Las ventajas de la memoria inmunológica innata no específica también podrían usarse para proporcionar protección contra patógenos previamente desconocidos y futuras pandemias. Este enfoque promete avances significativos en el desarrollo de vacunas, con el objetivo de mejorar los resultados de salud pública a nivel mundial, especialmente para las poblaciones de adultos mayores y personas inmunocomprometidas.
Bibliografía
Se citan algunas interesantes revisiones y trabajos, aunque son numerosos los disponibles:
Inmunidad entrenada
1. Lajqi T, Köstlin-Gille N, Gille C. Trained Innate Immunity in Pediatric Infectious Diseases. Pediatr Infect Dis J. 2023 Dec 27. doi: 10.1097/INF.0000000000004157. Epub ahead of print.
2. Bombassaro A, Figueiredo JM, Taborda CP, Joosten LAB, Vicente VA, Queiroz-Telles F, Meis JF, Kischkel B. Skin innate immune response against fungal infections and the potential role of trained immunity. Mycoses. 2024 Jan;67(1). doi: 10.1111/myc.13682.
3. Bulut O, Kilic G, Domínguez-Andrés J, Netea MG. Overcoming immune dysfunction in the elderly: trained immunity as a novel approach. Int Immunol. 2020 Nov 23;32(12):741-753. doi: 10.1093/intimm/dxaa052.
4. Domínguez-Andrés J, Dos Santos JC, Bekkering S, Mulder WJM, van der Meer JWM, Riksen NP, Joosten LAB, Netea MG. Trained immunity: adaptation within innate immune mechanisms. Physiol Rev. 2023 Jan 1;103(1):313-346. doi: 10.1152/physrev.00031.2021. Epub 2022 Aug 18.
5. Fanucchi S, Domínguez-Andrés J, Joosten LAB, Netea MG, Mhlanga MM. The Intersection of Epigenetics and Metabolism in Trained Immunity. Immunity. 2021 Jan 12;54(1):32-43. doi: 10.1016/j.immuni.2020.10.011. Epub 2020 Nov 20.
6. Murphy DM, Mills KHG, Basdeo SA. The Effects of Trained Innate Immunity on T Cell Responses; Clinical Implications and Knowledge Gaps for Future Research. Front Immunol. 2021 Aug 19;12:706583. doi: 10.3389/fimmu.2021.706583.
7. Netea MG, Domínguez-Andrés J, Barreiro LB, Chavakis T, Divangahi M, Fuchs E, Joosten LAB, van der Meer JWM, Mhlanga MM, Mulder WJM, Riksen NP, Schlitzer A, Schultze JL, Stabell Benn C, Sun JC, Xavier RJ, Latz E. Defining trained immunity and its role in health and disease. Nat Rev Immunol. 2020 Jun;20(6):375-388. doi: 10.1038/s41577-020-0285-6. Epub 2020 Mar 4.
8. Riksen NP, Netea MG. Immunometabolic control of trained immunity. Mol Aspects Med. 2021 Feb;77:100897. doi: 10.1016/j.mam.2020.100897. Epub 2020 Sep 2.
9. Ziogas A, Bruno M, van der Meel R, Mulder WJM, Netea MG. Trained immunity: Target for prophylaxis and therapy. Cell Host Microbe. 2023 Nov 8;31(11):1776-1791. doi: 10.1016/j.chom.2023.10.015.
10. Song Y, Mehl F, Zeichner SL. Vaccine Strategies to Elicit Mucosal Immunity. Vaccines (Basel). 2024 Feb 13;12(2):191. doi: 10.3390/vaccines12020191.
Vacunas basadas en la Inmunidad Entrenada
11. Sánchez-Ramón S, Conejero L, Netea MG, Sancho D, Palomares Ó, Subiza JL. Trained Immunity-Based Vaccines: A New Paradigm for the Development of Broad-Spectrum Anti-infectious Formulations. Front Immunol. 2018 Dec 17;9:2936. doi: 10.3389/fimmu.2018.02936.
12. Dominguez-Andres J, Netea MG. Long-term reprogramming of the innate immune system. J Leukoc Biol. 2019 Feb; 105(2):329-338. doi: 10.1002/JLB.MR0318-104R. Epub 2018 Jul 12.
13. Machado JN, Costa JC, Costa T, Rodrigues C. Mucosal bacterial vaccines in clinical practice - a novel approach to an old problem? Rev Assoc Med Bras (1992). 2020 May;66(5):659-665. doi: 10.1590/1806-9282.66.5.659. Epub 2020 Jul 3.
14. Martín-Rodríguez, Alberto & £, Héctor & Quezada, & Becerril Aragón, Gabriel Alfonso & £, Aragón & de la Fuente, César & Castillo-Juárez, Israel & Maeda, Toshinari & Salovarova, Valentina & Wood, Thomas & García-Contreras, Rodolfo. (2016). Recent Advances in Novel Antibacterial Development. Chapter 5. Frontiers in Clinical Drug Research: Anti-Infectives, Vol. 2, 2016,
15. Guevara-Hoyer K, Saz-Leal P, Diez-Rivero CM, Ochoa-Grullón J, Fernández-Arquero M, Pérez de Diego R, Sánchez-Ramón S. Trained Immunity Based-Vaccines as a Prophylactic Strategy in Common Variable Immunodeficiency. A Proof of Concept Study. Biomedicines. 2020 Jul 9;8(7):203. doi: 10.3390/biomedicines8070203.




















