Antecedentes
Si tenemos en cuenta que las especialidades farmacéuticas genéricas (EFG) han sido recientemente creadas por ley (ley 13/96 y circular 3/97), y los primeros genéricos aprobados de acuerdo con esta legislación lo fueron en Julio de 1997, deberíamos decir, hablando con propiedad, que el mercado de genéricos aún no existe en España.
Lo que si hay es alrededor de unas 100 especialidades que se comercializan con su DCI (Denominación Común Internacional) seguida del nombre de la empresa (por ej. Piroxicam Salvat, Diclofenaco Llorens, etc). En su momento no se les exigió demostrar bioequivalencia en el sentido que ahora se pide a las EFG y sólo se diferencian de las llamadas copias en el uso del nombre genérico en lugar de la marca y, en general, en un precio inferior.
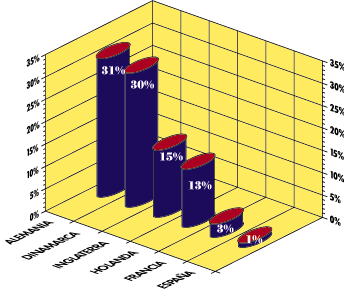
Tal como se aprecia en la tabla 1 estos pre-genéricos tienen una participación algo superior al 1% del mercado farmacéutico total en valores, claramente por debajo de la que presentan algunos de los principales países europeos (con la excepción de Francia e Italia), donde los genéricos constituyen un mercado que tiene tradición y un volumen importante.
TABLA1. PARTICIPACION DE GENERICOS (Valores)
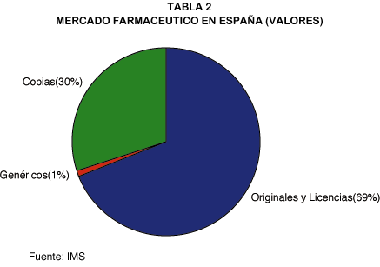
Estructura del mercado español
La estructura del mercado farmacéutico en España es muy distinta a la de los demás países europeos (tabla 2); en lugar de genéricos se han desarrollado las copias.
En nuestra opinión, ello se debe fundamentalmente a dos razones:
-
La ausencia de una ley de patente de producto hasta Octubre de 1992, que no tenía efectos retroactivos, ha favorecido la aparición e importancia de las copias cuyos rasgos básicos podemos resumir de la siguiente forma: a) lanzadas al mercado al poco tiempo de serlo el producto original; b) comercializadas con marca registrada; c) sin licencia del titular del producto original y d) con precios hasta hace poco tiempo, iguales o ligeramente inferiores a los del producto original. Así, principios activos como ciprofloxacino , enalapril y famotidino aparecen en más de 15 medicamentos con marca. Por otra parte, también es cierto que para otros productos comercializados en los últimos cinco-seis años (fluoxetina, sumatriptan, simvastatina) sólo han sido autorizados el original y, como máximo dos copias licenciatarias. Ello no se ha debido a un cambio en el sistema de patentes sino a un cambio en la política de las autoridades sanitarias.
-
Sistema de precios controlados. Otro factor que ha influido en el escaso desarrollo de los genéricos en España es, la existencia de un sistema de precios controlado, en contraposición a lo que ocurre en otros países europeos (tabla 3).
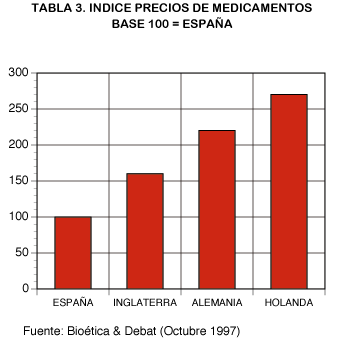
La autorización del PVP de la especialidad farmacéutica se produce a la vez que su autorización de comercialización. A partir de entonces una política de revisión de precios insuficiente, especialmente en épocas de inflación alta, da como resultado en España un índice de precios de los medicamentos sensiblemente más bajo que en otros países europeos.
Ello ha supuesto una barrera de entrada importante a los posibles genéricos que, solo podían explotar una diferencia de precio muy pequeña respecto al producto original.
Crecimiento del gasto farmacéutico y medidas de contención
La evolución creciente del gasto farmacéutico en los últimos años, del cual el 80% es objeto de financiación pública, ha hecho que desde hace unos años las autoridades sanitarias hayan puesto en marcha una serie de medidas cuyo objetivo es frenar el aumento del gasto farmacéutico.
He aquí una lista de las aplicadas desde 1992 (algunas de las cuales parece volverán a repetirse en fecha próxima) y sobre las que no me voy a detener en analizar su oportunidad y eficacia en conseguir su objetivo, ya que no constituyen el tema del presente artículo:
-
Reducciones de precios:
-
Reducción del PVL de un 3% (1992).
-
Reducción del IVA del 6% al 4% (1993).
-
Exclusión de 800 medicamentos de la financiación pública (1993).
-
Pacto de devolución por las compañías farmacéuticas del beneficio bruto diferencial obtenido a partir de un límite de ventas (crecimiento superior al 6%) (1996).
-
Disminución del precio de venta público con cargo al mayorista (su margen sobre el precio de venta a farmacia pasa del 12% al 11%) y a la farmacia (su margen sobre el PVP pasa del 29,9% al 27,9%) (1997).
Política de apoyo a los genéricos: Creación de un marco legal
Como otra alternativa para un mayor control del gasto farmacéutico, la Administración se ha planteado, primero, y ha iniciado, recientemente, una política de apoyo a los genéricos cuyo primer paso ha sido la creación de una normativa específica.
Así pues en la ley 13/96 de 30 de Diciembre, de Medidas Fiscales, Administrativas y de Orden Social se define que es una EFG y en la Circular 3/97, de 6 de febrero de la Dirección General de Farmacia y Productos Sanitarios se especifican las condiciones que deben reunir las EFG para ser autorizadas:
-
Definición: Especialidad con la misma forma farmacéutica e igual composición que otra original de referencia.
-
Condiciones de autorización:
-
Calidad contrastada por el correspondiente Drug Master File y los procesos de validación correspondientes.
-
Haber demostrado ser esencialmente similar a la especialidad original por medio de estudios de bioequivalencia. Esta es una condición universalmente aceptada que va estrechamente ligada a la intercambiabilidad y capacidad de sustitución entre ambas.
-
No aparecer en las relaciones de exclusión publicadas por las autoridades sanitarias
-
Identificada con el DOE (o en su defecto el DCI) seguido del nombre de la empresa
-
Incorporar las siglas EFG en el etiquetado.
-
Haber transcurrido más de 10 años desde la autorización en España de la especialidad original, o bien estar autorizada como genérico en un país de la UE.
Situación actual
De acuerdo con estos criterios, en Julio de 1997 se habían aprobado 6 genéricos: alopurinol, tamoxifeno, naproxeno (Ratiopharm), captopril, ranitidina, atenolol (Normon) a unos precios situados aproximadamente un 20%-30% por debajo del precio del medicamento original. Se trata de precios máximos ya que, como es bien sabido las empresas pueden bajarlos, previa comunicación a las autoridades sanitarias.
A mediados de Diciembre y sobre un total de 340 productos presentados había 14 genéricos autorizados y otros 100 tenían ya el conforme sanitario o estaban a punto de obtenerlo, entre ellos 37 copias.
A finales de año se esperaba que la Administración hubiese autorizado la comercialización de 80-100 genéricos correspondientes a 29 principios activos.
Productos candidatos a genéricos
En principio todos los productos cuyos principios activos reúnan las condiciones antes señaladas son posibles candidatos a su registro como genéricos.
No obstante, queremos señalar aquí unos factores asociados al producto original que, pueden determinar una mayor o menor participación del genérico y, por tanto, un mayor o menor éxito de ventas:
-
Vigencia terapéutica. Es decir, que a pesar del tiempo transcurrido desde su lanzamiento, el producto original siga teniendo un papel importante en el tratamiento de la indicación de que se trate
-
Volumen de ventas. Cuanto más elevadas sean las ventas del producto original, mayor será el número de genéricos que querrán canibalizarlas.
-
Precio. Cuanto más elevado sea el precio del producto original, más atractivo será para los potenciales genéricos, ya que habrá más oportunidad de explotar comercialmente de forma bien visible, por una parte, y con mayor rentabilidad, por otra, la diferencia de precios entre el original y el genérico.
-
Facilidad de producción. Cuanto más costoso, complejo y difícil sea fabricar el producto, menos genéricos competirán por este principio activo.
-
Tipo de indicación. En principio, los medicamentos genéricos para el tratamiento de patologías no crónicas (por ej. antibióticos, antimicóticos, etc) suelen tener una entrada más rápida y una mayor participación de mercado que los genéricos indicados para enfermedades crónicas (por ej. antianginosos, antiepilépticos) en las que el cambio de tratamiento por el médico es más difícil y donde también hay un grado de lealtad superior a la marca tanto por parte del médico como del paciente.
Ranitidina y captopril, principios activos recientemente aprobados como genéricos cumplen todas o casi todas de las condiciones anteriores.
Previsiones del mercado de genéricos
¿Qué se espera de este nuevo mercado de genéricos en términos de ventas y participación sobre el mercado farmacéutico total?
Las estimaciones realizadas por diversos expertos no coinciden, como es lógico esperar de un mercado que aún no ha empezado a andar y sobre el que se van a producir en el próximo futuro medidas y decisiones que van a afectarle significativamente.
Las previsiones que conocemos del mercado de genéricos para el año 2000 varían desde el 4%-5% sobre el mercado farmacéutico total, realizadas por el Profesor Pascual Segura (en ausencia de medidas drásticas), hasta el 10% que parece ser el objetivo de la Administración, pasando por el 6%-8% que es la previsión efectuada por el Dr. Reol Tejada, Director Técnico de Farmaindustria. (tabla 4).
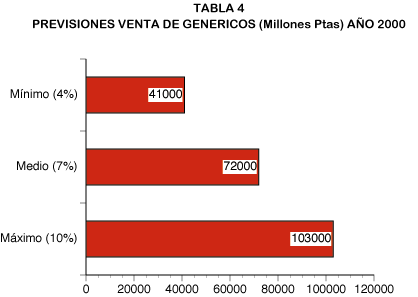
En cualquier caso, cifras importantes que, en el año 2000 multiplican entre cuatro y diez la cifra de ventas actual y disminuyen el gasto farmacéutico total entre un 1% y un 3%.
Condicionantes del nivel de introducción de los genéricos
El nivel de introducción de los genéricos en el mercado español dependerá, por una parte de la eficacia de las estrategias de las empresas farmacéuticas, tanto de las que comercializan productos originales y copias como las de genéricos.
También por otra parte, de la extensión, profundidad, aceptación, y en último término efectividad de las medidas que, para contener el gasto y fomentar el uso de genéricos, ponga en marcha la Administración dirigidas a los distintos integrantes de la cadena de valor del medicamento: industria, médico, mayorista, farmacia y paciente.
Empresas farmacéuticas
Empresas de originales. Aparte de la capacidad de poder ser los primeros en comercializar las versiones genéricas de sus productos de marca y así aprovechar precios más altos y una mayor facilidad de stock por el mayorista, estas compañías disponen de otra serie de posibilidades para defender las ventas de sus productos originales:
-
Traspasar previamente las ventas a extensiones de línea, y nuevas indicaciones protegidas por patente
-
Invertir en promoción de lealtad a la marca
-
Invertir en promoción a farmacias tratando de contrarrestar la sustitución por genéricos
-
Formar específicamente a la red de ventas en aspectos farmacoeconómicos.
Empresas de copias. Desde hace algún tiempo y para determinados principios activos (por ej. omeprazol, captopril) se observa como algunos preparados copias basan su argumentación de venta exclusivamente en el precio, situación que era totalmente impensable hace sólo unos pocos meses.
Curiosamente se está dando el caso de que alguno de los genéricos recientemente aprobados lo ha sido a precios superiores a los que actualmente tienen determinadas copias (por ej. Capoten Normon, PVP 60 comprimidos 25 mg = 2196 pts; Tensoprel (Rubio), PVP 60 comprimidos 25 mg = 2097 pts).
Por último señalemos, como ya se ha mencionado anteriormente, que un número determinado de copias (37) que reunía las condiciones legales para serlo, ha solicitado su conversión en genéricos.
Empresas de genéricos. Las empresas que ya han tomado posiciones para el comienzo del lanzamiento de genéricos en España deberán, de entrada, hacer frente a la imagen bastante generalizada de los genéricos como medicamentos baratos y de calidad dudosa, además de suponer una seria amenaza para la investigación y desarrollo de medicamentos innovadores por la industria farmacéutica.
Por tanto, será muy importante para las empresas que comercialicen genéricos disponer, de un prestigio y una imagen que infunda confianza y seguridad para así poder superar, con mayor facilidad, el reto que supone persuadir a los médicos que los productos genéricos tienen la misma calidad que la marca original.
Asimismo la asignación eficiente de los recursos comerciales tiene aquí un papel aún más importante que en el caso de los productos originales, si tenemos en cuenta una disponibilidad inferior fruto de su menor margen bruto.
Medidas de apoyo a los genéricos
Para fomentar el mercado de genéricos la Administración puede utilizar una serie de medidas dirigidas hacia todos los integrantes de la cadena del medicamento y a ellas me voy a referir en los siguientes apartados.
Quede bien claro que lo que sigue es solo una descripción de posibilidades y no una toma de partido en favor o en contra de los genéricos. Para cada una de las potenciales medidas que se citan a continuación, las autoridades sanitarias deberán valorar muy bien su aceptación por los implicados, su eficacia para contener el gasto farmacéutico y, especialmente, los efectos negativos que puedan tener sobre aspectos importantes tales como el desarrollo de la industria farmacéutica, el principio de equidad, la libertad de prescripción, el futuro de la farmacia, etc.
Precios de referencia en España
La fijación de un sistema de precios de referencia suele ser la primera medida asociada a la existencia de un mercado de genéricos. En principio, no modifica el esquema de copago por el paciente y básicamente trata de limitar la financiación pública a los medicamentos de menor precio. Teóricamente con este sistema se debe desplazar la dispensación de medicamentos de marca más caros hacia genéricos más baratos.
En España los precios de referencia se contemplan ya en la ya mencionada ley 13/96: "... ... de entre las distintas alternativas bioequivalentes disponibles sólo serán objeto de financiación con cargo al Sistema Nacional de la Salud las especialidades farmacéuticas cuyos precios no superen la cuantía que para cada principio activo se establezca reglamentariamente".
A continuación dice que el usuario podrá elegir otra especialidad de precio más elevado prescrita por el médico siempre que pague la diferencia entre el precio de esta y el de la especialidad farmacéutica financiada por el Sistema.
Este es el concepto general. Sin embargo aún faltan completar aspectos que concreten el alcance de esta medida:
-
Principios activos sobre los que se aplicará. Se habla de que, en principio, afectará a unos 8-10 principios activos: los de mayor venta entre los genéricos aprobados.
-
Sistema de cálculo. Parece ser que se calculará según el precio medio de los productos con el principio activo de que se trate. Si es así, el precio de referencia se situará, en la mayoría de casos, por debajo del precio del original pero por encima del precio del genérico.
-
Determinación del plazo de validez y sistemas de revisión del precio de referencia.
-
Precios de referencia en Europa
Llegados a este punto debemos decir que la mayoría de países que, hasta ahora han implantado los precios de referencia, lo han hecho en unas condiciones muy distintas a las que actualmente tiene el mercado español.
En efecto, los países europeos que, a partir de 1988 y, hasta ahora, han desarrollado los precios de referencia: Alemania, Holanda, Suecia y Dinamarca comparten un sistema de libertad de precios; un índice de precios alto y un mercado de genéricos maduro. En consecuencia, una diferencia de precios significativa entre el precio de los productos originales y los genéricos.
Aún a pesar de ello, en estos países el esquema de precios de referencia no ha conseguido los efectos esperados sobre la contención del gasto público en medicamentos, según un exhaustivo estudio sobre el tema recientemente publicado (Ver Bibliografía general -Segú J.L y Zara C. El sistema de preus de referencia.)
En primer lugar, en el submercado en que se han aplicado los precios de referencia se ha conseguido una disminución del precio medio que, por otra parte, se ha compensado parcialmente con un aumento del consumo en unidades.
En segundo lugar, en el submercado de productos que quedan fuera de los precios de referencia se ha producido un aumento del gasto farmacéutico, que parece explicarse por las siguientes razones:
-
Incrementos de precios, para compensar las reducciones de precios de los productos que las empresas tiene sometidos a precios de referencia .
-
Aumento del número de nuevos productos con pequeñas variaciones sobre los existentes, pero a precios más altos.
-
Desplazamiento de la prescripción médica hacia este tipo de productos, consecuencia de una mayor inversión promocional dirigida hacia ellos.
-
Estímulos a la prescripción médica de genéricos
Aparte de tener una clara inclinación, que viene de lejos, por la prescripción de marcas, los médicos suelen ver en los genéricos una limitación a su libertad de prescripción.
Las medidas dirigidas a fomentar la prescripción de genéricos por el médico pueden tener un carácter más bien persuasivo intentando convencerle de la bondad de esta práctica y en este sentido se incluyen las campañas pro-genéricos y de familiarización con los principios activos, pero también pueden haber otras más radicales como las siguientes:
-
Programa de uso racional del medicamento: Guías fármacoterapéuticas de área, boletines de medicamentos y protocolos terapéuticos de las patologías más prevalentes.
-
Impulso de sesiones de formación continuada.
-
Presupuestos indicativos por médico, equipo de atención primaria o módulo organizativo en los centros de salud, con incentivos económicos ligados a su cumplimiento.
-
Inspecciones y controles.
Distribución y dispensación de medicamentos
Por una parte la Ley de Acompañamiento de los Presupuestos Generales del Estado ya contempla la sustitución de productos dentro del esquema de precios de referencia: "una vez fijados los precios de referencia el responsable de la oficina de farmacia estará facultado para poder sustituir el medicamento prescrito por un genérico que fuera equivalente terapéuticamente, teniendo que abonar el ciudadano la diferencia si optara por el fármaco recetado, y éste superara el precio de referencia".
"Si el médico prescriptor identifica en la receta una especialidad farmacéutica genérica, solo podrá sustituirse por otra especialidad farmacéutica genérica"
Por otra parte, el sistema actual de retribución de mayoristas y farmacias en forma de un margen lineal fijado por ley (porcentaje fijo sobre el PVL) incentiva, desde un punto de vista económico, la venta del mayor número de unidades al mayor precio.
Por tanto, medidas como un sistema de márgenes escalonados según el precio o un margen especial para los productos genéricos, la fijación dentro de estos márgenes de una cantidad atribuible al acto profesional de la dispensación, ó el establecimiento de una compensación global por la pérdida de beneficios originada por la sustitución por genéricos, favorecerían, desde una perspectiva exclusivamente empresarial, la sustitución de medicamentos originales por genéricos por parte de las farmacias y posiblemente, también el stock de genéricos por los mayoristas.
Pacientes
Para finalizar, mencionemos las medidas que dirigidas a pacientes/usuarios pueden fomentar el desarrollo del mercado de genéricos.
Por una parte, se podría aumentar el porcentaje de financiación privada del medicamento. Por otra, llevar a cabo una información correcta y suficiente que alerte al usuario de la existencia de alternativas que le supondrán pagar más o menos por un tratamiento determinado.
En ambos casos, si la diferencia es significativa, aparte de la posibilidad de elección por el paciente, también podría darse una cierta forma de presión al médico para que prescriba de forma genérica resultado que es, en principio, dudoso dado el papel protagonista actual del médico en este tipo de toma de decisiones.
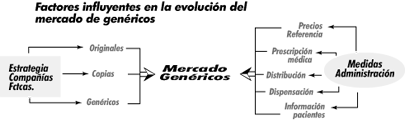
Como conclusión final, quisiera repetir una vez más que la futura evolución del mercado de genéricos va a depender de muchos factores, entre ellos de una serie de medidas a tomar por parte de la Administración, quien no debería olvidar entonces la profundidad de posibles efectos perjudiciales en todos y cada uno de los integrantes de la cadena del medicamento: industria, mayorista, médico farmacia y sobre todo el paciente.
Bibliografía general
Diaz Garcia J.M. Genéricos en la oficina de farmacia: perspectivas de utilización. Farmacia Profesional 1997; Diciembre.
Segú J.L y Zara C. El sistema de preus de referencia com a mecanisme de regulació del mercat farmacéutic: descripció, impactes i aplicabilitat a Espanya. Bioética & Debat 1997; Octubre.
Segura P. Patentes y medicamentos genéricos en España. Industria Farmacéutica 1997; Marzo-Abril 1997.
Segura P. The peculiar patent and generic situation in Spain. Scrip Magazine 1997; Junio.
Summers K.H. Research companies go generic- Dangerous Liaisons?. Pharmaceutical Executive.1993; Noviembre
Thwaite E.H. Beat the generics by joining them. Medical Marketing & Media 1992; Setiembre.
















