Los estudios post-autorización EPA permiten conocer algún aspecto relacionado con los efectos beneficiosos y perjudiciales de los medicamentos, así como las características relacionadas con su utilización, en las condiciones habituales de la práctica clínica, en aquellas indicaciones para las que fueron autorizados.
Por lo que los EPA nacen con el fin de completar la información obtenida durante las fases I, II y III y contribuir a su mejor utilización. En este contexto, Internet y la telefonía móvil han facilitado el desarrollo de estos estudios mediante la tecnología e-trials.com o e-clinical.com.
Ventajas del sistema e-trials
Se trata de un sistema informatizado que permite al investigador introducir datos e información de manera interactiva en un programa que puede estar instalado en su ordenador o en un dominio de internet propiedad de nuestra compañía, Biomedical Systems con lo que la captura de datos sería on-line y confidencial.
De esta forma la tecnología e-trials permite mayor grado de fiabilidad y rapidez al contar con un servidor de internet seguro y propio, que garantiza la integridad y confidencialidad de todos los datos recibidos y almacenados.
Por su parte, a los investigadores/usuarios se les provee del ordenador necesario para poder introducir la información y enviarla a la central de datos: además, todos los investigadores/usuarios forman parte de una Intranet que permite la emisión y recepción de correo electrónico del proyecto. Esto permite el intercambio de información entre ellos y también con la central de datos, facilitando la comunicación, el control y la gestión de estas investigaciones con fármacos.
Otra de las ventajas de la utilización de la tecnología e-trials en los estudios postautorización es que el programa emite informes automáticos e inmediatos con un rápido análisis de los datos introducidos. Otro aspecto a destacar es que esta nueva tecnología facilita la edición de cartas, el acceso a bases de datos, bibliografía y cualquier información necesaria para la investigación y desarrollo del estudio, así como la optimización de plazos en la disponibilidad y emisión de información para informes de seguridad por comunicación expeditiva de acontecimientos adversos graves e inesperados.
Ventajas del e-trials.com
• Reducción de costes en los estudios de investigación médica y farmacoepidemiológica.
• Obtención de mejores resultados y con mayor rapidez.
• Captura de datos críticos e información en tiempo real.
• Interacción del programa con el investigador (usuario): indica los pasos a seguir en cada situación, detecta los errores en la información introducida, alerta sobre parámetros médicos, recalcula datos, etc...
• Toma rápida de decisiones y soluciones ya que se dispone de toda la información centralizada del estudio totalmente actualizada debido al envío constante de datos por los investigadores a través de los ordenadores.
• Generación automática de informes.
• Seguridad, fiabilidad y calidad de los datos.
• Recepción y gestión inmediata de toda la información en el servidor de la central de datos.
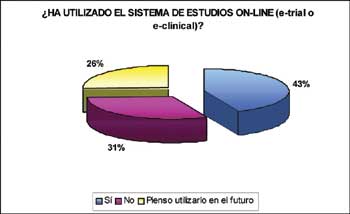
Situación de los estudios clínicos post-autorización
Según un reciente estudio elaborado por Biomedical Bioestatistic, división de Biomedical Systems Group, la utilización de los estudios on-line en los laboratorios farmacéuticos ha experimentado un aumento muy grande en los últimos años.
Según los resultados de este trabajo que recoge la opinión de los profesionales de la industria farmacéutica sobre el futuro de los estudios clínicos post-autorización, un 43,3% de los encuestados afirma usar habitualmente tecnología e-trials o e-clinical en Ensayos Clínicos.
|














