Los complementos alimenticios son alimentos cuyo fin es complementar la dieta normal con ingredientes que tienen funciones nutricionales o fisiológicas. Debido al aumento de la presencia y demanda de estos suplementos o complementos alimenticios en las farmacias el farmacéutico comunitario tiene que actualizar sus conocimientos para seleccionar aquellos con suficiente calidad, seguridad y evidencia científica. En este artículo se describen los aspectos más importantes que tiene que tener en cuenta el farmacéutico para realizar una correcta dispensación de estos preparados alimenticios.

Los complementos alimenticios junto con otros tipos de productos (alimentos funcionales, productos dietéticos y nutrición enteral) actúan de manera beneficiosa para prevenir los problemas relacionados con la alimentación y paliar sus consecuencias (perdida de salud y de calidad de vida).
Por complemento alimenticio se entiende cualquier producto consistente en una fuente concentrada de nutrientes, que se presenta en forma dosificada (cápsula, tableta, polvo, gotas, ampollas) y cuyo fin es complementar la ingesta de dichos nutrientes en la dieta normal. El empleo de complementos alimenticios debe efectuarse siempre con carácter individualizado, considerando el estado nutricional del paciente o cliente.
Es de especial importancia que el farmacéutico tenga conocimientos no solo en la farmacología e indicación farmacéutica más adecuada de dichos complementos sino también en la normativa. Por ejemplo, los complementos alimenticos son tratados como alimentos que no requieren una autorización previa para su comercialización sino una notificación de puesta en el mercado. La responsabilidad sobre la calidad del producto recae exclusivamente sobre el fabricante. De ahí la importancia que los farmacéuticos sean consientes de esta situación, seleccionen cuidadosamente los productos que introducen en su farmacia, para evitar no sólo los que no cumplan la normativa vigente, sino también los que no aporten la calidad suficiente o aquellos a los que se atribuyan propiedades basadas en afirmaciones carentes de rigor científico.
1. Marco legal de los complementos alimenticios. Situación actual
1.1 Legislación
Los complementos alimenticios fueron regulados por primera vez en 2002 mediante la Directiva 2002/46/CE del Parlamento Europeo y del Consejo, de 10 de junio de 2002 (1). En esta directiva se regularon las vitaminas y minerales (Anexo I, tabla 1) y las correspondientes formas químicas permitidas (Anexo II).
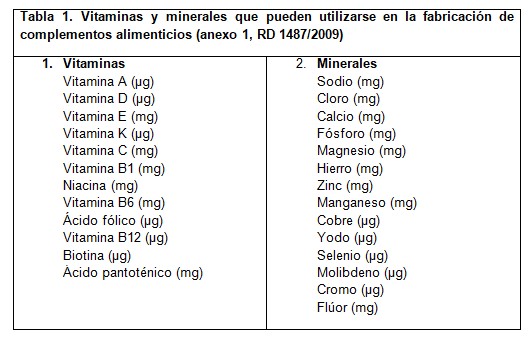
La transposición de la Directiva 2002/46/CE a nuestro ordenamiento jurídico se hizo un año más tarde, con la publicación del Real Decreto (RD) 1275/2003 (2), referido a los complementos alimenticios se establecieron unos niveles máximos, que permitan garantizar que la utilización normal de estos productos de acuerdo con las instrucciones de uso dadas por el fabricante no presenta peligro para los consumidores. En el año 2009 se derogó y se publicó el RD 1487/2009 (3). En este RD sólo se establecen limitaciones y criterios de pureza para las vitaminas y los minerales y para aquellas sustancias enumeradas en el anexo II para las que la legislación comunitaria no especifique criterios de pureza se aplicarán los criterios reconocidos por la normativa española-.
Finalmente, en el año 2018 se publicó un RD 130/2018 (4) por el que se modifica el Real Decreto 1487/2009 con la inclusión de un nuevo (anexo III) con otras sustancias que pueden ser utilizadas en la fabricación de estos productos (lista positiva de minerales y vitaminas). En esta lista se incluyen aminoácidos, ácidos grasos esenciales, fibras y diversas plantas y extractos de hierba que no fueron reguladas en la Directiva 2002/46/CE, indicando que siguen estando sujeta a las normas que, en su caso, se emplean en las legislaciones nacionales. También se establece el principio de reconocimiento mutuo que los complementos alimenticios legalmente fabricados o comercializados en un Estado miembro de la UE, deberán poder comercializarse en España con independencia de que contengan sustancias distintas de nutrientes no específicamente previstas en este nuevo Real Decreto.
1.2 Niveles máximos de seguridad
Para proteger al consumidor de un consumo excesivo de vitaminas y minerales, y puesto que sus niveles máximos no se han establecido a escala europea, la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN) publica en su página web, en la sección de complementos alimenticios, una tabla resumen de los niveles máximos de ingesta admisible (UL, upper level) establecidos por la European Food Safety Authority (EFSA) (5). Dichos niveles se refieren a la ingesta diaria de cada uno de ellos (vitaminas y minerales), teniendo en cuenta todas las fuentes de la dieta.
1.3 Etiquetado
Se regula según Reglamento (UE) 1169/2011 (6) de 25 de octubre, sobre la información alimentaria facilitada al consumidor y además a los artículos 5 y 6 del RD 1487/2009.
En etiquetado del producto debe contener la cantidad de nutrientes o de sustancias con un efecto nutricional o fisiológico de manera numérica (tabla 2). Esta cantidad numérica se tiene que expresar en porcentaje de los valores de referencia (VRN).
Los Valores de Referencia de Nutrientes (VRN) pueden definirse como los niveles de ingesta de nutrientes adecuados para alcanzar los requerimientos nutricionales de prácticamente todas las personas sanas.
El contenido mínimo significativo debe aportar al menos el 15% de los VRN por dosis diaria (anexo III, RD 1169/2011)
Aparte de la lista y la cantidad de los ingredientes, debe presentar la fecha de duración mínima o caducidad, las condiciones especiales de conservación, el modo y empleo, la identificación y domicilio del fabricante, el lote y el lugar de origen y procedencia.
No debe sugerir la propiedad de prevenir, tratar o curar una enfermedad humana, ni se referirá en absoluto a dichas propiedades. Tampoco debe indicar que sea sustituto de una dieta equilibrada.
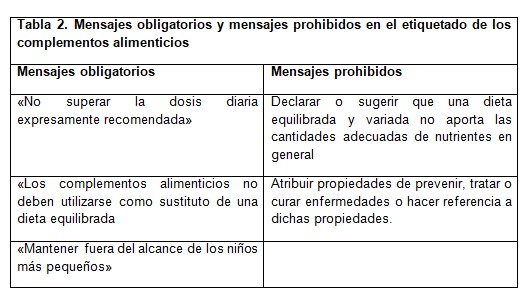
Las declaraciones de propiedades saludables y nutricionales no son obligatorias, pero deben figurar en el etiquetado del complemento alimenticio. Su normativa básica se encuentra en el Reglamento (CE) Nº1924/2006 (7) del Parlamento Europeo y del Consejo. Solo se pueden utilizar aquellas que aparecen en los listados de declaraciones autorizadas de la Unión, además ajustarse a las disposiciones del Reglamento en la forma de expresarse y presentarse. De lo contrario se considerarán publicidad engañosa. Dicho listado se puede consultar en la página http://www.efsa.europa-eu/en/topic/nutrition.htm. Su utilización nunca podrá ser falsa, engañosa, ni inducir a error al consumidor, alentar o tolerar el consumo excesivo o subestimar la importancia de una dieta saludable ni referirse a cambios en las funciones corporales que puedan crear alarma en el consumidor.
1.4 Restricciones y prohibiciones de uso
En el anexo III del Reglamento (CE) 1925/2006 (8) la lista actualizada de sustancias distintas de las vitaminas o minerales cuyo uso en los alimentos está prohibida, restringida o sujeta a control comunitario.
-Hoja de aloe que contenga hidroxiantracénicos: dantrona, aloe-emodina, emodina
-Hierbas de ephedra
-Corteza de yohimbina
1.5 Ingredientes no armonizados
En el caso de ingredientes no armonizados por la legislación nacional y reconocidos por el principio de reconocimiento mutuo se podrá comprobar su seguridad de la siguiente forma:
-En el caso que sean agentes biológicos: bacterias, hongos, levaduras EFSA tras sus estudios de riesgo ha otorgado la categoría de “Presunción de seguridad” y se puede consultar en el siguiente enlace: http://www.efsa.europa.eu/en/efsajournal/pub/3449.htm.
-En el caso de plantas medicinales disponible en https://www.efsa.europa.eu/en/efsajournal/pub/2663.
-En relación con los nuevos alimentos disponible en http://ec.europa.eu/food/food/biotecnology/novelfood/nfnetweb/index.cfm.
-En el caso de que presente ingredientes que presentan acción farmacológica se debe consultar el centro de información online de Medicamentos de la AEMPS-CIMA, en este caso se debería autorizarse como medicamento y no como alimento.
http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm
2. Dispensación y consejo farmacéutico de complementos alimenticios
En la dispensación de estos productos el farmacéutico comunitario debería hacer una recomendación individualizada para cada cliente, tendiendo en cuenta las necesidades nutricionales, sus hábitos de vida, enfermedades y posibles interacciones con otros alimentos y medicamentos.
Las necesidades nutricionales de vitaminas dependen del sexo, actividad física, la edad y el estado fisiológico (embarazo, lactancia, enfermedades). En circunstancias normales, una dieta adecuada y equilibrada proporciona todos los nutrientes necesarios.
Un aporte insuficiente de vitaminas en la dieta da lugar a déficits vitamínicos que pueden corregirse mediante suplementación.
Las ingestas recomendadas vienen definidas en el RD 1275/2003, se definen como la cantidad de energía y nutrientes que debe contener la dieta diariamente para mantener la salud de virtualmente todas las personas sanas de un grupo homogéneo (97,5% de la población).
En la siguiente tabla (tabla 3, 9) se indican las vitaminas hidrosolubles y liposolubles, las ingestas recomendadas, la dosis máxima permitidas y las causas de deficiencia. En las sociedades desarrolladas prácticamente han desaparecido los clásicos cuadros de avitaminosis, pero existen grupos de población en riesgo con deficiencias subclínicas o marginales debido a diferentes circunstancias (bajo consumo de alimentos -personas de edad, regímenes de adelgazamiento mal programados-, gestantes, lactantes, problemas de absorción, alcoholismo crónico, etc.).

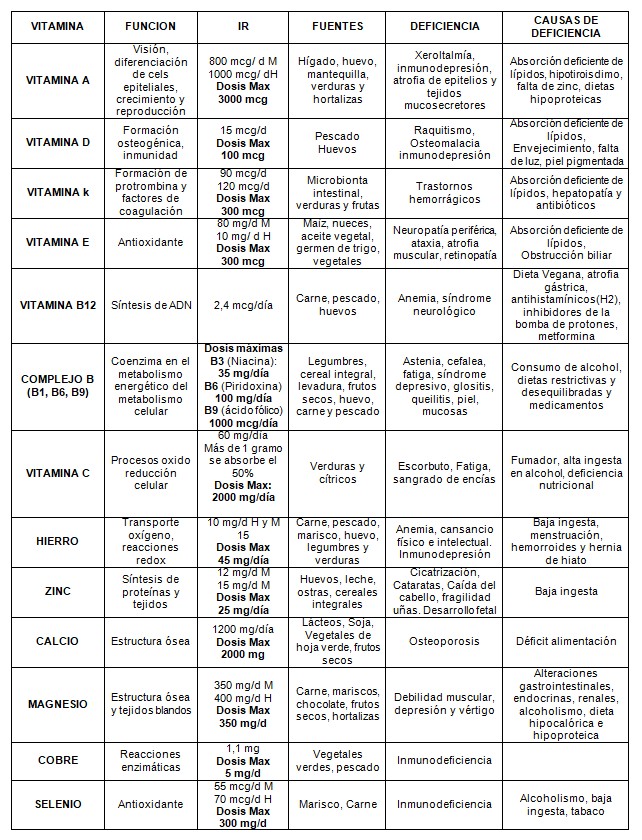
Los efectos adversos que produce la ingesta excesiva de las vitaminas hidrosolubles son poco habituales debido a que se excretan a través de la orina y no se almacenan en el organismo, siendo mayor en el caso de las liposolubles que tienden a almacenarse de forma más prolongada y, en consecuencia, su riesgo de toxicidad es mayor. La tiamina se excreta en leche en cantidades inferiores a las cantidades diarias recomendadas. Sin embargo, debido a la tiamina que puede recibir el niño por otras fuentes, se recomienda utilizar con precaución estos suplementos durante la lactancia. La ingesta excesiva de vitamina A puede producir hipervitaminosis especialmente en pacientes con alteración de la función renal o hepática y grandes consumidores de alcohol. Durante el embarazo puede producir defectos en el feto, por lo que durante este período es especialmente importante que las dosis sean acordes a las necesidades de la gestante. El exceso de vitamina D durante la lactancia puede producir hipercalcemia prolongada puede conducir a retraso mental y físico, estenosis aórtica y retinopatía en el niño.
En el caso de los minerales, hay que tener en cuenta que ciertos pacientes pueden ser más susceptibles a sus efectos. Por ejemplo, en el caso de pacientes con enfermedad de Addison, enfermedad cardiopulmonar grave, enfermedad renal o hepática no se deben administrar suplementos de fósforo por riesgo de hiperfosfatemia o hipocalcemia grave. En individuos con enfermedad de Wilson y hemocromatosis, el cobre puede producir toxicidad crónica a niveles de ingesta muy bajos.
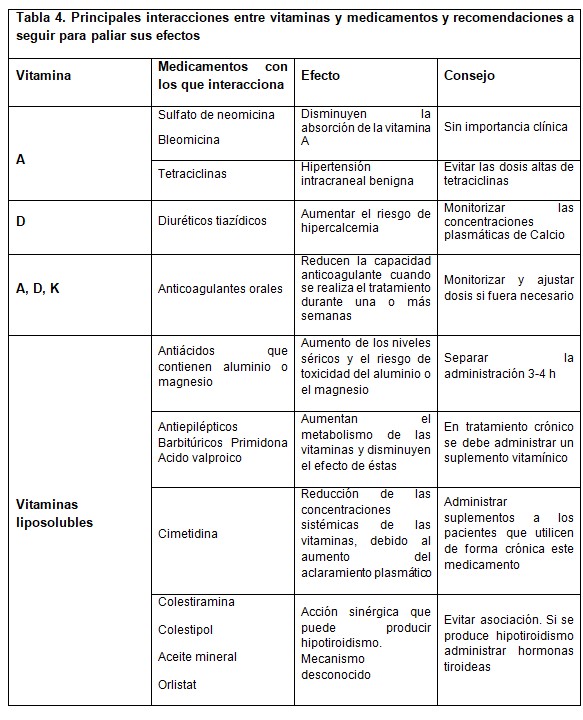
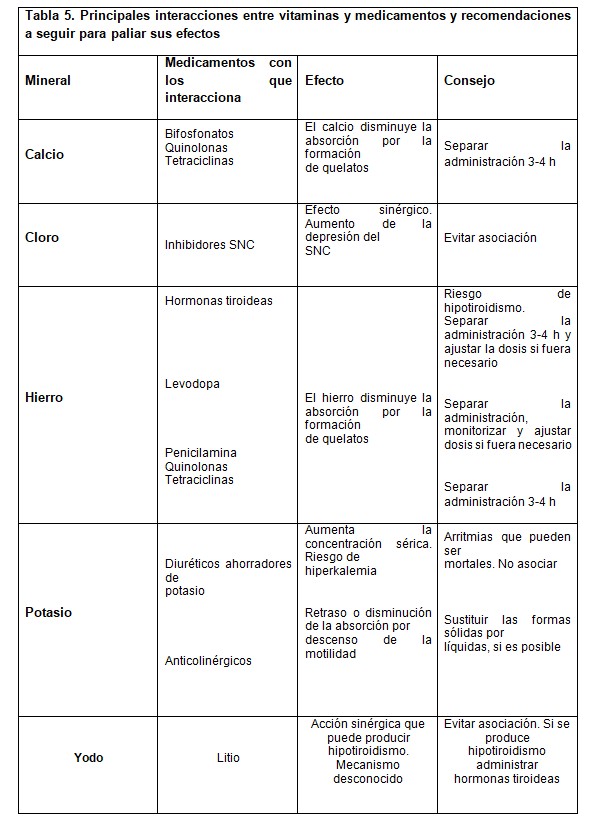
Las interacciones medicamento-complemento alimenticio (a base de vitaminas y minerales) (Tabla 3 y 4, 10, 11) son muy variables y comprenden desde déficits nutricionales provocados por fármacos que impiden la absorción de nutrientes hasta efectos adversos de fármacos relacionados con ciertos nutrientes. Los nutrientes que presentan el mayor número de interacciones con los fármacos son las vitaminas:
Ciertos fármacos como los inhibidores del dihidrofolato reductasa y los antagonistas del ácido fólico (metotrexato, trimetoprim, pirimetamina o aminopterina) o con tratamiento crónico con anticonvulsivantes suelen presentar deficiencia de ácido fólico en sangre. Todos los fármacos que inhiben la secreción ácida o tienen un efecto alcalinizante van a inhibir la absorción de vitamina B12 (cimetidina, ranitidina, antiácidos tipo bicarbonato).
Ciertos anticoagulantes (antivitamina K), el uso de antibióticos (destrucción de la flora intestinal), medicamentos conocidos como secuestradores del ácido biliar (resinas de intercambio iónico) pueden reducir la absorción de vitamina K.
La vitamina E en dosis elevadas (mayores de 400 UI) y los ácidos grasos omega-3 contenidos en los aceites de pescado en diferentes complementos alimenticios pueden potenciar los efectos de los anticoagulantes, aumentando el riesgo de sangrado.
Las concentraciones plasmáticas de calcio se deben monitorizar en caso de administración conjunta de diuréticos tiazídicos con vitamina D debido al riesgo de hipercalcemia. Se debe separar la toma de calcio (3-4 horas) junto con ciertos antibióticos debido a la formación de quelatos que retrasan su absorción. La administración conjunta de sales de hierros con ciertos medicamentos (levodopa, hormonas tiroideas, y ciertos antibióticos) disminuye la absorción de estos medicamentos por formación de quelatos.
Bibliografía
1- Directiva 2002/46/CE del Parlamento Europeo y del Consejo, de 10 de junio de 2002, relativa a la aproximación de las legislaciones de los Estados miembros en materia de complementos alimenticios.
2-RD 1275/2003, de 10 de octubre, relativo a los complementos alimenticios. BOE» núm. 246, de 14 de octubre de 2003.
3-RD 1487/2009 de 26 de septiembre, relativo a los complementos alimenticios. BOE núm. 244, de 9 de octubre de 2009.
4-RD 130/2018 de 16 de marzo, por el que se modifica el Real Decreto 1487/2009, de 26 de septiembre, relativo a los complementos alimenticios. BOE núm. 75, de 27 de marzo de 2018.
5-Niveles máximos de ingesta admisible (Tolerable Upper Intake level) para vitaminas y minerales evaluados por EFSA. Disponible en: https://www.aesan.gob.es/AECOSAN/web/seguridad_alimentaria/subdetalle/niveles_maximos.htm
6- Reglamento (UE) No 1169/2011 del parlamento europeo y del consejo de 25 de octubre de 2011 sobre la información alimentaria facilitada al consumidor y por el que se modifican los Reglamentos (CE) no 1924/2006 y (CE) no 1925/2006 del Parlamento Europeo y del Consejo. Disponible en: https://www.boe.es/doue/2011/304/L00018-00063.pdf
7- Reglamento (CE) nº 1924/2006 del Parlamento Europeo y del Consejo de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos, para ser utilizadas en el etiquetado, presentación y publicidad de los productos alimenticios comercializados en la Unión Europea.
8-Reglamento (CE) nº 1925/2006 del parlamento europeo y del consejo de 20 de diciembre de 2006, sobre la adición de vitaminas, minerales y otras sustancias determinadas a los alimentos.
9-Paolo M, Suter, Robert M Russell. Deficiencia y exceso de vitaminas y oligoelementos en Harrison, Principios de medicina interna. Segunda edición, Mexico. Mc Graw Hill; 2018.
10-Ortiz de Zárate Juan del Arco. Dispensación de complementos alimenticios. Farmacia profesional. Vol. 24, Núm. 5, Septiembre-Octubre 2010 (52-59).
11- Ortiz de Zárate Juan del Arco. Dispensación de complementos alimenticios. Farmacia profesional. Vol. 24, Núm. 2, Marzo-Abril 2010





















