El panorama actual de la seguridad de los medicamentos está experimentando una rápida evolución en el sector de las ciencias de la vida. A medida que se incrementa el volumen de casos y se disponen de nuevas fuentes de datos, los equipos de seguridad enfrentan una complejidad creciente para garantizar un cumplimiento de máxima calidad al tiempo que introducen productos en el mercado.

La globalización del sector impone a los equipos de seguridad la necesidad de adaptarse a nuevos retos y oportunidades, lo que incluye abordar los riesgos y regulaciones emergentes en diversas regiones y mercados. En la actualidad, los avances en tecnología, automatización y análisis de datos ofrecen oportunidades para mejorar las prácticas de seguridad en las organizaciones de ciencias de la vida. Aprovechando estas capacidades, las organizaciones pueden identificar y abordar proactivamente problemas de seguridad, optimizar el rendimiento de la gestión de casos y mejorar los resultados de seguridad para los pacientes.
En términos generales, el futuro de la seguridad en el sector de las ciencias de la vida se caracteriza por Innovarse y adaptarse a las tendencias tecnológicas en evolución. Aquellas organizaciones que aprovechen eficazmente estos avances pueden obtener un valor significativo al mejorar el rendimiento de la seguridad y los resultados para los pacientes.
Introducción General
El año 2023 representó un periodo transformador en el ámbito de las Ciencias de la Salud y de la Vida, donde se evidenciaron cambios y desafíos significativos, pero también surgieron oportunidades para la transformación y el crecimiento en un entorno cada vez más dinámico y competitivo. El sector farmacéutico europeo, en concreto, sigue creciendo y afrontando desafíos relacionados con el acceso al mercado, la disponibilidad, la gestión de la seguridad y la distribución de medicamentos respectivamente.
En abril de 2023 se presentó el primer borrador de la revisión de la Legislación Farmacéutica Europea después de 20 años. La Comisión Europea está trabajando en la Estrategia Farmacéutica de la UE para reforzar la producción de medicamentos en Europa, basada en la innovación y la competitividad. El ciudadano está en el centro de esta dinámica supranacional. La seguridad, la regulación, el coste, la calidad, la información, la protección del medio ambiente y la digitalización serán claves en el desarrollo de esta estrategia. Si bien los borradores sobre protección de patentes y los incentivos a la I+D están generando incertidumbre, el creciente aumento en las fusiones y adquisiciones impulsa el optimismo, ya que las mismas, pueden impulsar la innovación, mejorar la eficiencia y fortalecer la posición competitiva de las empresas farmacéuticas.
La financiación disponible tras la recuperación de la pandemia de COVID-19 podría desempeñar un papel fundamental en la remodelación del sistema de salud europeo. Se anticipa que la inversión en infraestructura, tecnología médica y recursos humanos fortalezca la capacidad de los sistemas de salud para hacer frente a futuras crisis de salud pública y mejore la atención médica en general.
Como parte de una entrevista reciente con PharmaBoardroom, Emer Cooke, directora ejecutiva de la Agencia Europea de Medicamentos (EMA), detalló cuatro áreas clave de enfoque para la Agencia en los próximos años. En todas ellas sobrevuela la intención de mejorar y reforzar la seguridad de los medicamentos. Aprender de la experiencia COVID, abordar las resistencias antimicrobianas y fomentar una sólida infraestructura europea de ensayos clínicos fueron las tres primeras. La más importante por los temas que tratamos fue querer establecer estrategias para mejorar la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos, involucrando directamente a los pacientes y apostar por la recopilación y difusión de evidencias del mundo real (Real World Data-RWD), reconociendo su significativo impacto en la toma de decisiones y las prácticas médicas.
Al diseñar esta tertulia-entrevista conjunta, mis compañeros y yo optamos por transmitir un mensaje que suscitara debate. Más allá de abordar el "cómo" de las cosas, nuestro objetivo era generar un debate y reflexión entre aquellos que ya tienen conocimientos sobre cómo llevar a cabo ciertas tareas. La audiencia a la que nos dirigimos en esta entrevista probablemente defenderá que su labor dentro de un equipo de seguridad del medicamento no es simplemente un centro de costos, sino un centro de beneficio e inversión. Estamos seguros de que los lectores estarán ansiosos por resaltar y compartir los efectos positivos a largo plazo de la colaboración entre departamentos científicos y equipos de negocio.
A continuación, les presento brevemente a los profesionales que me acompañan y los principales conceptos planteados, sin duda elementos clave, para que los departamentos de Vigilancia, de los laboratorios farmacéuticos, descubran la realidad de su auténtico valor estratégico.
Dr. Antonio Borregón, MD, PhD, Global Business Development Pharma Head QbD Group, médico y veterinario con una amplia experiencia en la industria farmacéutica. Le preguntaré básicamente sobre la integración de tecnología para farmacovigilancia y las estrategias glocales para armonizar los informes de seguridad en diferentes regiones dentro de los laboratorios farmacéuticos, como parte de ese valor estratégico.
Dr. Richard Habis, farmacéutico y experto estratégico en Real World Data (RWD) y soluciones digitales para mejorar la atención centrada en el paciente. Es un apasionado defensor del estudio de la hemofilia y las enfermedades raras. Le preguntaré sobre los enfoques de farmacovigilancia centrados en el paciente a través de tecnologías sanitarias digitales y cómo aprovechar los datos en tiempo real (RWD) para mejorar la seguridad de los medicamentos.
¿Cómo moderador de esta entrevista me gustaría destacar, en este momento, CUÁLES SON LOS TRENDING TOPICS, con relación a la seguridad de los medicamentos?
De todas las contribuciones y datos que nos llegan me gustaría destacar las siguientes, porque en mi opinión, transforman la manera en que llevamos a cabo nuestra estrategia de seguridad.
- Las empresas se ven sometidas a una presión cada vez mayor, para aprovechar las innovaciones tecnológicas, la automatización y los datos y análisis del sector, con el fin de obtener resultados transformadores. Se espera que las organizaciones adopten enfoques más ágiles y eficientes para el desarrollo de medicamentos y la gestión de la seguridad. La inversión en I+D ha crecido significativamente en los últimos años y eso influye en la presión de estas para ser rápidos y eficientes en la comercialización.
- La evolución de la normativa regulatoria global va acompañada de nuevas fuentes de datos e influida por terapias cada vez más innovadoras. Las agencias reguladoras, por eso, necesitan armonizar con prioridad en los sistemas de seguridad garantizando un cumplimiento optimo.
- El reto de los laboratorios farmacéuticos consiste en gestionar adecuadamente las nuevas fuentes de datos, ya que disponen ahora de muchos más datos que nunca. Sin estrategias de gestión de datos y soluciones adaptadas al sector, las organizaciones tendrán dificultades para superar ese frente y obtener información útil.
- Pero si hay que elegir entre todos los “trending Topics” me quedo con el crecimiento significativo del volumen de casos de reacciones adversas en seguridad de medicamentos, con informes que sugieren un aumento del 30-50% anual, según International Data Corporation (IDC). Se atribuye a diversos factores, como la introducción de productos médicos complejos y terapias específicas, el envejecimiento de la población, el aumento de las enfermedades crónicas y el mayor acceso a fuentes de datos reales.
Dr. Borregón ¿QUE REFLEXIONES SUSCITAN ESTOS TRENDING TOPICS?
Es evidente que las organizaciones deben desarrollar estrategias para gestionar todo lo anterior con eficiencia operativa y financiera. Pueden beneficiarse de la utilización de los equipos de farmacovigilancia como impulsores del negocio, a través de una gestión de proactiva de detección de señales. Desde mi punto de vista la seguridad debe y puede convertirse en un motor de valor estratégico.
Los departamentos de Farmacovigilancia en la industria que yo he conocido han sido considerados como centro de costes. Pero en estos momentos yo los animaría a enfrentarse a un reto muy bonito, que es gestionar el cumplimiento y la seguridad de los pacientes a pesar de contar con recursos, presupuestos y plazos más limitados. Yo les invito a “salir de la caja” y buscar la optimización de sus operaciones y procesos, aprovechando las tecnologías avanzadas.
Todo esto hace preguntarme Dr. Borregón ¿CÓMO ACONSEJARIAS PARA CONVERTIR LA SEGURIDAD EN UN MOTOR DE VALOR ESTRATÉGICO?
Como hemos comentado a lo largo de la entrevista la gestión apropiada de la seguridad genera un valor añadido a cualquier organización de ciencias de la vida. Hay que ser consciente de que medida que las organizaciones se esfuerzan por lanzar más productos al mercado más rápidamente y con mejores resultados para los pacientes, es fundamental romper con la visión tradicional de la seguridad.
Por tanto, los equipos de seguridad de medicamentos pasan de ser un centro de costes reactivo a un motor de beneficios proactivo cuando las propias organizaciones proporcionan las herramientas y los recursos adecuados. Hacer que los equipos se centren en actividades que aporten valor e identificando mejores aspectos de la seguridad que contribuyan a mejorar al rendimiento final del producto.
Dr. Borregón, me da curiosidad el concepto Glocalizacion. ¿Qué te sugiere? Por otro lado ¿es la generación de evidencias una tarea claramente proactiva de los departamentos de Seguridad y Medical Affairs?
Me alegro, ya que La "glocalización" es un término que combina las palabras "globalización" y "localización". Se refiere a la adaptación de productos, servicios o estrategias a las condiciones específicas de un mercado local, manteniendo al mismo tiempo una perspectiva global.
En el contexto de la seguridad de los medicamentos, la glocalización implica tener en cuenta las diferencias legales, normativas y culturales de cada país o región, a pesar de utilizar metodologías y tecnologías globales y comunes.
Respecto a la generación de evidencias, es una tarea esencial y multifacética que implica recopilar información para respaldar la seguridad y eficacia de los medicamentos. En términos de proactividad, los departamentos de Seguridad y Medical Affairs desempeñan un papel clave. Proactivamente, pueden llevar a cabo estudios, análisis de datos y evaluaciones para identificar posibles problemas de seguridad, así como para generar evidencia adicional que respalde la calidad y eficacia de los medicamentos. Este binomio debe conllevar un componente de proactividad y no de reactividad.
¿Porque hemos de ser proactivos Dr. Borregón?
Pues porque hay que ir a buscar qué es lo que está sucediendo en el medicamento. Ser PROACTIVO es enfocarse en la interpretación de señales del mundo real y post comercialización (p.ej. cumplimiento por parte del paciente, determinantes medioambientales, etc.). Asimismo, trabajar cada vez conjuntos de datos más grandes y complejos con información valiosa sobre el rendimiento de los medicamentos y productos biológicos tanto en eficacia vs. seguridad en las subpoblaciones de pacientes y en los diferentes estadios de enfermedad.
Dr. Borregón qué oportunidades ves en el concepto Consultoría en Vigilancia.
Habiendo crecido este mercado en este sector de una manera significativa, es evidente que los laboratorios farmacéuticos por diversas razones buscan compañeros estratégicos y tácticos para el viaje de su producto sea biotecnológico, vacunas, biológicos, biosimilares o medicamentos tradicionales, en donde la investigación clínica. Y el seguimiento post comercialización conlleva una proactiva gestión de los datos de seguridad y por supuesto las revisiones científicas de lectura critica, ya sea en forma de búsquedas bibliográficas o de revisión de la de la información médica en el entorno multicanal.
Además, las ventajas de la externalización son evidentes. Sin necesidad de perder la visión estratégica los equipos de seguridad de un laboratorio farmacéutico descansan en el proceso táctico del día a día y en el acompañamiento de la estrategia con actividades proactivas de la nueva Biofarmacovigilancia que en QbD Group llamamos One Vigilance.
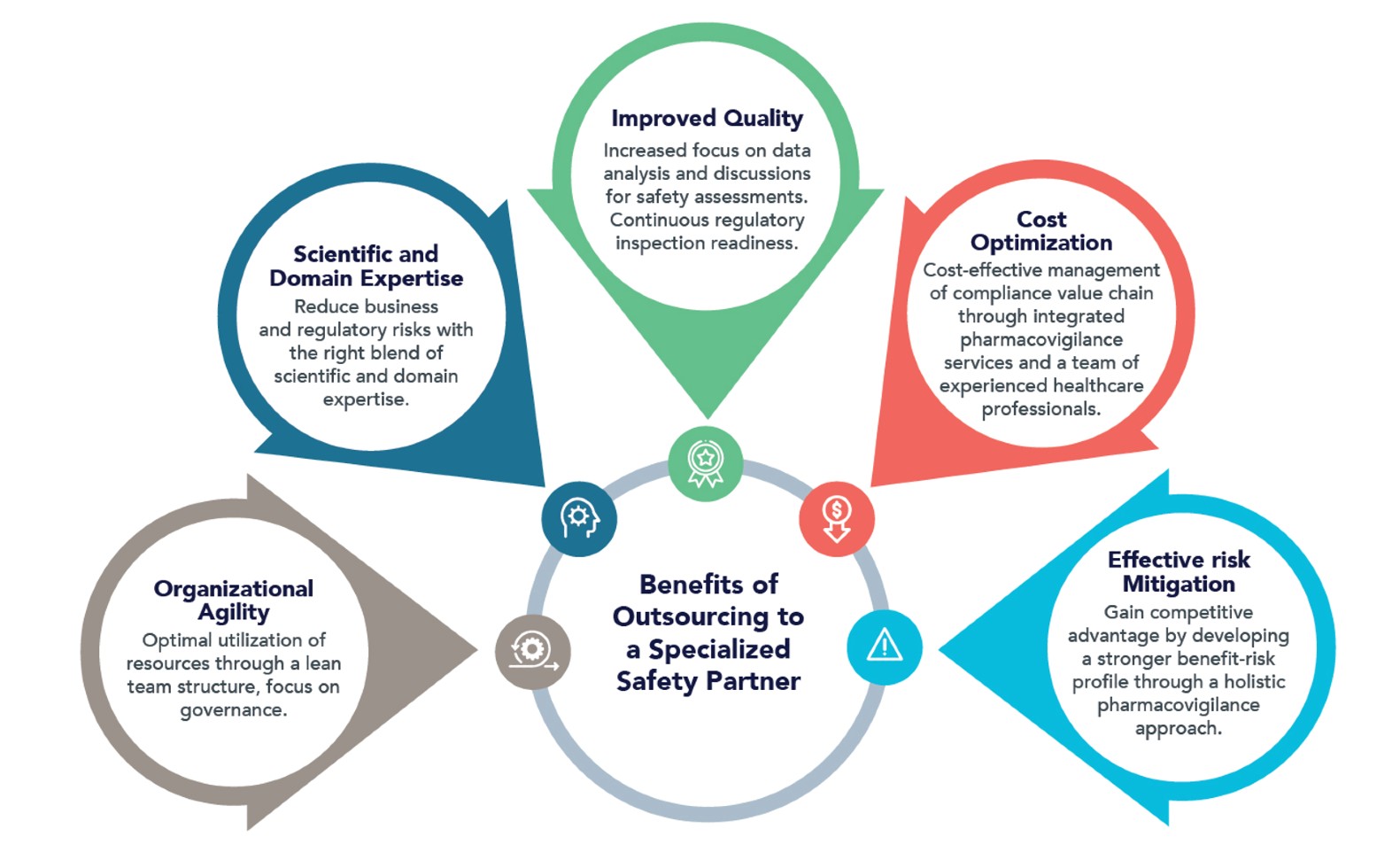
En QbD Group entendemos la importancia de la cadena de valor y nos dedicamos a proporcionar un apoyo integral para garantizar el éxito de sus productos en cada etapa de su viaje en la cadena de valor. QbD Group es su Consultora de referencia en la industria farmacéutica y biotecnológica.
Ofrecemos asistencia estratégica y táctica a nivel regulatorio y de seguridad, tanto en Europa como en otros mercados clave como China y LATAM. Prestamos servicio a todas las empresas del sector farmacéutico y biotecnológico, ayudándolas a navegar por complejos entornos normativos y a garantizar el cumplimiento de las normas de seguridad. Y especialmente se centra en este aspecto de la vigilancia proactiva, acompañando las tareas tácticas y tradicionales de la seguridad.
Por eso nuestro servicio global se llama ONE VIGILANCE y hace hincapié en la seguridad como actividad generadora de ingresos y no de gastos, ofreciendo un enfoque integral con experiencia global de principio a fin.
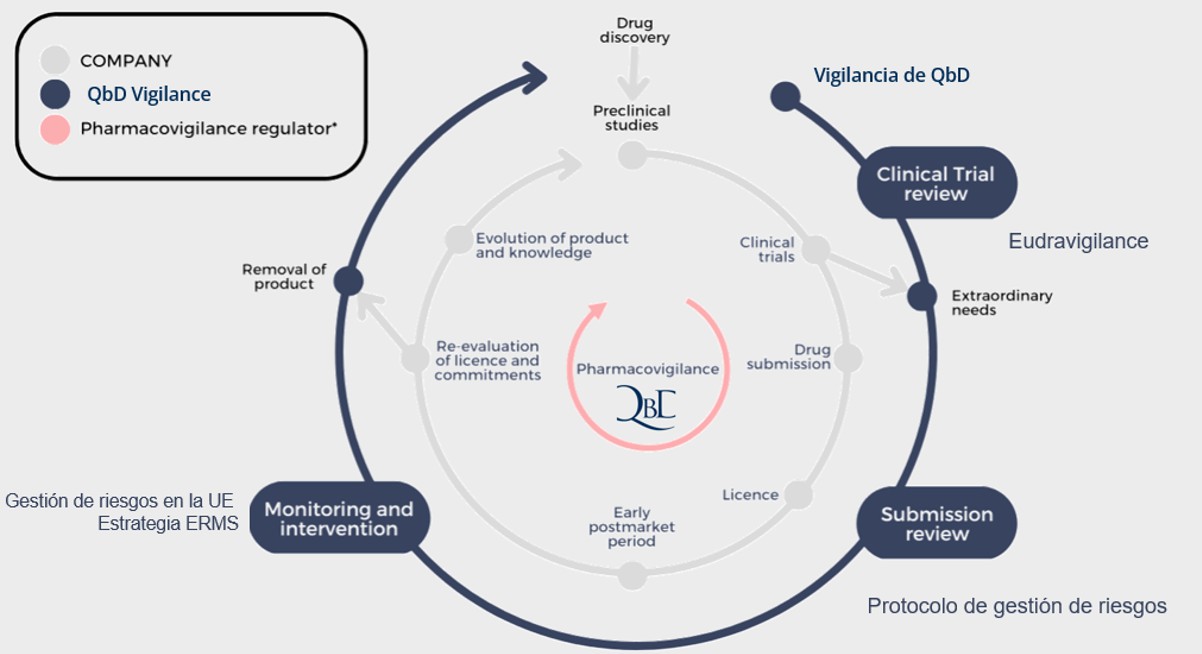
Dr. Habis ¿qué significa la Farmacovigilancia centrada en el paciente? ¿Supone de verdad una mejora del control de la seguridad de los medicamentos?
La Farmacovigilancia centrada en el paciente es una estrategia que busca mejorar la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos mediante la participación directa de los pacientes en el proceso. Este enfoque implica transformar la relación tradicional, donde los pacientes son receptores pasivos de la atención médica, a que sean participantes activos en la notificación y seguimiento de la seguridad de los medicamentos. Al involucrar a los pacientes de esta manera, se busca lograr varios objetivos:
1. Mejorar la calidad, cantidad y puntualidad de los datos de seguridad: Al contar con la participación de los pacientes, se espera obtener información más completa y precisa sobre los efectos de los medicamentos en la vida real.
2. Pertinencia, exactitud y accesibilidad de la información sobre seguridad: La participación de los pacientes puede proporcionar perspectivas únicas y valiosas sobre su experiencia, lo que contribuye a una comprensión más completa de los perfiles de seguridad de los medicamentos.
3. Mejorar la confianza, la experiencia y la adherencia al tratamiento: Al hacer que los pacientes se sientan parte activa del proceso de farmacovigilancia, se puede mejorar la confianza en los tratamientos, la experiencia general de atención médica y la adherencia a los medicamentos.
4. Fomentar una cultura de transparencia, responsabilidad y aprendizaje: La participación de los pacientes puede contribuir a una cultura más abierta y transparente en el campo de la farmacovigilancia, promoviendo la responsabilidad compartida y el aprendizaje continuo.
En resumen, la Farmacovigilancia centrada en el paciente tiene el potencial de mejorar significativamente el control de la seguridad de los medicamentos al aprovechar la valiosa información y perspectivas que los pacientes pueden aportar al proceso.
Dr. Habis ¿Que aportan para ti las soluciones sanitarias digitales?
Efectivamente, las aplicaciones sanitarias, la telemedicina y los "wearables" (dispositivos portátiles ) representan herramientas valiosas que van más allá de su función principal, convirtiéndose en canales efectivos para la capacitación de los pacientes y la mejora del monitoreo de la seguridad y adherencia a los medicamentos. Aquí hay algunos aspectos clave:
- Capacitación de los Pacientes: Las aplicaciones sanitarias y las plataformas de telemedicina ofrecen recursos educativos y herramientas interactivas que capacitan a los pacientes sobre sus condiciones de salud, tratamientos y la importancia de la farmacovigilancia. Esto contribuye a una mayor comprensión de los pacientes sobre su propia salud y tratamiento.
- Notificación de Acontecimientos Adversos: Estas tecnologías permiten a los pacientes notificar fácilmente los acontecimientos adversos o efectos secundarios que experimentan en tiempo real. Esta retroalimentación directa es valiosa para el proceso de farmacovigilancia, ya que proporciona información actualizada sobre la seguridad de los medicamentos en el mundo real.
- Monitoreo en Tiempo Real: Los "wearables" y otras tecnologías de seguimiento permiten el monitoreo continuo de parámetros de salud y adherencia al tratamiento. No solo ayuda a los pacientes a gestionar su salud, sino que también proporciona datos en tiempo real a los profesionales de la salud para evaluar la eficacia y seguridad de los tratamientos.
- Integración de Datos: La integración de datos de estas tecnologías en los sistemas de salud electrónicos facilita el acceso de los profesionales de la salud a la información completa sobre el estado de salud y el cumplimiento de los pacientes. Esto mejora la toma de decisiones clínicas y la gestión de la seguridad.
En conjunto, estas herramientas digitales no solo facilitan la atención médica a distancia, sino que también fortalecen la participación de los pacientes en la gestión de su salud y contribuyen al monitoreo efectivo de la seguridad y adherencia a los medicamentos.
Dr. Habis ¿Que tecnologías en concreto pueden utilizarse?
Salud móvil / Aplicaciones de acompañamiento utilizadas tanto en ensayos clínicos como en el mundo real para los resultados comunicados por los pacientes (PRO) permitiendo que los pacientes y cuidadores informen proactivamente de síntomas y acontecimientos
Dispositivos portátiles “Wearables” para controlar las constantes vitales del paciente y los efectos de la medicación en tiempo real, lo que mejora el control de la seguridad con Atención proactiva al paciente y seguimiento continuo. No olvidemos que las herramientas de monitorización a distancia permiten un seguimiento continuo del estado de salud del paciente.
Plataformas de telemedicina utilizadas para facilitar las consultas de pacientes a distancia, el seguimiento y la notificación de los resultados sanitarios de los pacientes y la seguridad de la medicación.
Dr. Habis ¿Que aportan para ti los datos de vida reales (Real world data-RWD)? Como aprovechar el RWD para mejorar la seguridad de los medicamentos
Lo cierto Dr. Navarro es que RWD es una mina de información que transforma el panorama de la farmacovigilancia. Tener en cuenta que de los pacientes se puede aprovechar información proveniente de fuentes no estructuradas como la historia clínica electrónica, Bases de datos de reclamaciones, registros de pacientes, estudios observacionales, datos generados por los propios pacientes, tecnologías sanitarias digitales (aplicaciones, dispositivos portátiles, etc) y por supuesto las redes sociales
Estamos ante un papel creciente de la RWD en la farmacovigilancia, conformándose como una nueva oportunidad para la supervisión proactiva de la seguridad, complementando las pruebas de los ensayos controlados y recogidos de fuentes ajenas a los juicios tradicionales.
En conclusión, permitidme que concluya esta entrevista y me pregunte ¿cuáles son los siguientes pasos?
- Búsqueda constante de la aportación de valor añadido.
- Considerar el modelo Glocal.
- Centrar la Biofarmacovigilancia proactiva o modelo ONE Vigilance en el paciente.
- Trabajar con datos del mundo real (RWD).
- Trabajar en el futuro de la Biofarmacovigilancia.
Y una llamada a la ACCION:
- Seamos digitales, Seamos agiles, Generemos confianza. Revise su coste operativo de su plan de acción.
- Identifique el nivel tecnológico y la escalabilidad ante cambios de su portfolio.
- Evalúe sus gastos operativos y la dedicación de su equipo vs. calidad, explotación riesgo.
- Determine la oportunidad de externalización del servicio de Vigilancia.
En QbD Group, somos expertos en Farmacovigilancia y en Seguridad de Medicamentos. No dudes en contactarnos para ver como nuestras soluciones pueden ayudarte.
















