En el actual contexto, incluso situaciones “menores” de no Compliance o el no respeto de los códigos deontológicos pueden derivar en significativas penalizaciones civiles, criminales, daños y perjuicios. El riesgo no sólo comporta denuncias, multas u otras sanciones, las compañías arriesgan mucho más: su reputación y la confianza de sus clientes….Las organizaciones que puedan demostrar su fuerte compromiso con el proceso de Compliance y con altos niveles de transparencia en sus operaciones estarán bien posicionadas para reducir riesgos y mejorar su imagen pública.
La realidad es que durante años se han generado ciertas sospechas en torno al comportamiento de la industria farmacéutica con la comunidad médica responsable de la prescripción. En los últimos años se ha hecho un esfuerzo considerable, a veces obligado por las regulaciones, para conseguir mejorar la percepción de la industria.
¿Por qué hablamos de obligación? Bien, no hay duda de que la tendencia hacia una mayor transparencia en las regulaciones que afectan a la industria de las ciencias de la salud está modificando sus operaciones y la percepción del gran público. En este ámbito, es crítico para el buen desarrollo del negocio aprovechar la oportunidad de no sólo mejorar procesos aumentando transparencia, sino también para adoptar nuevas estrategias de Compliance que cumplan con las normativas y se adapten mejor a los nuevos retos del mercado.
En Estados Unidos, Europa y Australia, muchas agencias reguladoras y asociaciones de la industria, han tomado la iniciativa de incorporar mayor transparencia y control financiero en sus normativas referentes a interacciones con instituciones sanitarias y profesionales de la salud.
Un reciente informe (1) sobre la industria señala que la tendencia regulatoria en Europa, sorprendentemente, en algunos países, excede incluso los niveles de exigencia de Estados Unidos; así mismo el estudio realiza un análisis actualizado de las compañías que lideran la implantación de procesos, sistemas y estrategias de Compliance adaptadas a esta nueva realidad.
Sea a través de leyes o estrictos códigos, Europa debe ahora afrontar una compleja y creciente estructura de regulaciones dictadas para la industria de las ciencias de la salud. Encontramos ejemplos de esta realidad en el Reino Unido con el “UK Bribery Act”, que ha fortalecido sus provisiones o en Francia donde últimamente se han llevado a cabo reformas -“Réforme du Médicament”- que exigen informes significativamente más sofisticados y detallados que la regulación americana - “US PPACA’s Sunshine Provisions”- y que requieren que los datos sean publicados.
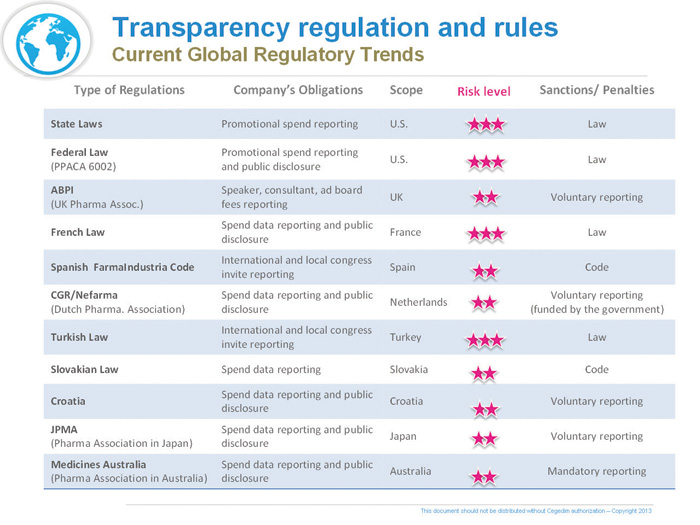
Estos importantes cambios en Compliance vienen en parte motivados por infracciones en diferentes países europeos que han sido altamente publicitadas en los medios de comunicación, con su consecuente escándalo público que ha derivado reacciones políticas acordes.
El resultado de esta tendencia regulatoria es que las operaciones comerciales de la industria se ven afectadas de forma constante y permanente por los legisladores europeos a través del desarrollo de códigos normativos paneuropeos que estimulan un autocontrol proactivo. Un reflejo de esta pro-actividad se encuentra hoy en muchas compañías donde los requerimientos internos frecuentemente son más exigentes que las regulaciones nacionales o incluso que los actuales códigos deontológicos.
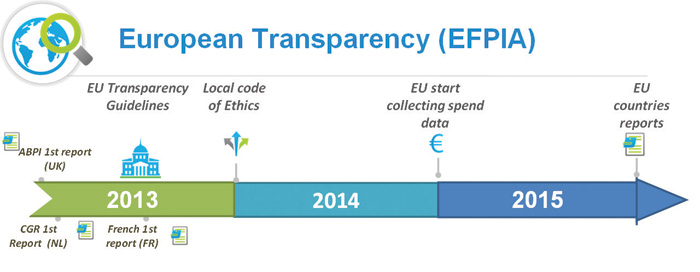
La federación europea de las industrias farmacéuticas y asociaciones (EFPIA) planifica guiar y alcanzar la consolidación del gasto agregado para el 2015 y hacer los datos públicos para 2016. En una entrevista en la conferencia internacional de Medicina Farmacéutica en noviembre de 2012 (2) José Zamarriego, director de la Unidad Deontológica de Farmaindustria, subrayó que “La transparencia tiene la virtud de dar seguridad” también mencionó “Aunque el programa final del nuevo código no está aún cerrado, lo más relevante consiste en ampliar las relaciones con la industria de una forma positiva reconociendo su valor. Esto, sin duda, incrementa la transparencia y consecuentemente la credibilidad y confianza en la industria farmacéutica”.
Así pues, muchas de las políticas que están siendo adoptadas por la industria son proactivas y voluntarias: El informe “Cegedim Survey Report” (1) constata cómo las compañías farmacéuticas están reaccionando implementando altos niveles de auto control. Específicamente, la mayoría de los encuestados (82%) mencionaron que sus compañías vigilan el cumplimiento de estándares corporativos en el gasto con profesionales de la salud. Operacionalmente, un significativo número de encuestados (46%) han tomado medidas para prevenir comportamientos non-Compliant. Un 43% declara haber optimizado sus procesos de negocio y un 43% dice estar diseñando e implementando reglas internas.
En cuanto a la inversión dedicada a este área, más de la mitad de encuestados (55%) ya han asignado recursos para sostener un equipo de Compliance dedicado a velar por el cumplimiento regulatorio, y un 44% han aprovechado los sistemas de aprobación previa de gastos e inversiones que afectan a profesionales médicos con fines de Compliance.
Claramente, las compañías europeas apuestan por un futuro operacional cumplidor con las regulaciones.
Pilares del cambio en el camino hacia un Compliance operacional
Alcanzar Compliance en las operaciones requiere la superación de ciertos obstáculos y cuellos de botella. A menudo ocurre que sistemas y procesos se quedan cortos, pobres en su contenido o con errores en sus datos. Dichos elementos o su combinación afectan la capacidad de mantener los estándares normativos. En el estudio mencionado anteriormente se preguntó específicamente por los procesos que entrañaban mayor dificultad: la respuesta del 36% se refirió a la gran dificultad de hacer corresponder diferentes fuentes de información y llegar a un identificador único de cada profesional de la salud que permita consolidar y aunar las diferentes fuentes de datos. A destacar que estos obstáculos pueden ser el resultado de mecanismos ineficientes de generación de informes: tres cuartos de los encuestados (75%) utilizan sistemas desarrollados internamente (44%) o procesos manuales soportados en Excel (31%). La previsión en torno al desarrollo de Compliance sugiere la necesidad de implementar buenas prácticas: el 73% de los encuestados anticipan nuevas leyes de anticorrupción que afectarán no sólo cada vez a más países, también con mayores exigencias de transparencia.
Las dificultades asociadas a Compliance, a medida que aumentan las nuevas regulaciones, no deben ser subestimadas. Muchas compañías farmacéuticas tienen dificultades para analizar el mejor modo de afrontar las transformaciones necesarias. Incluso organizaciones multinacionales con experiencia en la implantación de medidas de cumplimiento con el “Sunshine Act” reevalúan cómo hacer converger todos los datos de los diferentes pagos gestionados en diversos sistemas para llegar a un repositorio único que consolide toda la información.
El gran volumen y dispersión de fuentes de datos a considerar añade complejidad a este proceso. Muchas compañías no disponen ni de recursos internos ni de sistemas que les permitan consolidar toda la información necesaria en un formato único, fiable y seguro.
Encontramos evidencia de esta gran cantidad de datos y procesos en el informe recientemente publicado por la ABPI (“Association of the British Pharmaceutical Industry”)(3) que señala cómo en el Reino Unido el total de pagos de las compañías farmacéuticas a profesionales de la salud en concepto de apoyo y patrocinio alcanzó en 2012 los 40 millones de libras.
La ABPI indicó que sus miembros publicarían los totales agregados de todos los pagos hechos durante el pasado año a médicos, enfermeras y otros profesionales de la salud como parte de su política de transparencia.
En 2011 los miembros de la ABPI votaron cambios en los códigos de conducta haciendo de las anteriores indicaciones un requerimiento en aras de un aumento efectivo del nivel de desconfianza y transparencia en las prácticas de trabajo entre farmacéuticas y profesionales médicos.
Esta obligación afecta a los pagos realizados como patrocinio de eventos médicos educacionales, formaciones y honorarios a ponentes empleados del NHS (National Health System). Todas las compañías publicarían el número de profesionales que participaban en dichos programas susceptibles de derivar pagos.
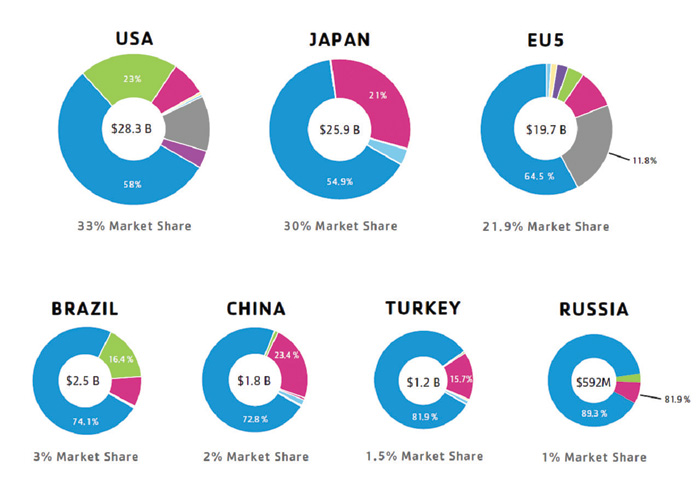
Si tomamos una perspectiva más amplia de lo que ocurre a escala global, auditorías del gasto en marketing e inversiones en muestras, reuniones y ensayos clínicos, es fácil entender la gran magnitud de la tarea que supone mostrar los gastos agregados y generalizar la transparencia de las operaciones de la industria.
El mejor enfoque
El primer paso clave consiste en realizar un análisis de los diferentes sistemas en marcha, de cómo se guarda registro de los pagos, de cómo estos sistemas intercambian datos y de qué manera se analiza la información. Dotadas de esta inteligencia, las organizaciones están en posición de establecer los siguientes pasos necesarios para llegar a una situación de Compliance: consiguiendo cumplir con las regulaciones. Esto suele incluir transformaciones de datos para limpiar, armonizar y estandarizar los mismos; seguidamente proceder con la integración en un único repositorio que asegure la identificación (gracias a una clave única maestra) de cada entidad e individuo y sus niveles de gasto. Con este único repositorio común que aporta una visión agregada, las organizaciones pueden automatizar la generación de informes fiables tanto para su gestión interna, el público, asociaciones médicas o autoridades gubernamentales.
Retos operacionales en el cumplimiento con las regulaciones
Las compañías que no sean capaces de identificar a sus clientes en las diferentes fuentes y sistemas que gestionan gastos, se encontrarán con una monitorización imprecisa, informes con desviaciones e incurrirán en riesgo de non-Compliance. Para prevenir estas situaciones, antes de asignar a cada cliente su identificador único, las compañías han de hacer un esfuerzo de alineamiento de los diferentes sistemas y responsables, así como asegurarse que sus empleados registren información precisa y completa en las diferentes herramientas que intervienen en la gestión de gastos.
Sumando el problema de disponibilidad de datos completos y las dificultades de integración, la tarea se presenta enorme y compleja.
Las compañías han de ordenar los datos internos y externos que deseen capturar, así como su tipo y formato. Esto es especialmente importante cuando se desarrolla un repositorio integral maestro, que requiere por un lado la alineación de procesos a diferentes niveles: local e internacional y por otro la correcta realización de múltiples tareas técnicas: comparación y mapeo de ficheros, sistemas de validación y verificación de datos, definición del identificador único de la base global de datos.
Soluciones tecnológicas
Los retos mencionados pueden superarse gracias a soluciones tecnológicas diseñadas específicamente para unificar, asegurar un robusto soporte de los flujos de los distintos procesos internos, registrar los gastos agregados y alertar a los usuarios de transacciones financieras sospechosas optimizando la monitorización del proceso de Compliance. Estas tecnologías deben mantener informados a los ejecutivos, siendo capaces de generar informes que incorporen tanto reglas de negocio capaces de lanzar alertas a los usuarios como reportes predefinidos o adaptados a las necesidades específicas de cada compañía.
La importación de datos debería de simplificarse y permitir múltiples puntos de entrada: conectores con otras aplicaciones de negocio, interfaces lanzados cuando se estime necesario, entrada manual vía user interface… Cualquier nuevo dato introducido debe ser controlado a través de un exhaustivo seguimiento (audit trail) y monitorizado vía un sistema automatizado de control de calidad y reporte.
Identificación única
Muchas compañías dudan de la capacidad de sus sistemas internos como idóneo y fiable soporte para contener el repositorio de datos de referencia, donde converjan los diferentes sistemas que los gestionan; siendo éste el primer eslabón de la cadena y cimiento para mantener registros precisos y asegurar Compliance.
Una ventaja añadida sería utilizar sistemas capaces de comparar los datos de gasto de las compañías con una base de datos de referencia del personal sanitario para asegurar el mantenimiento de la información actualizada. Para maximizar la fiabilidad se requeriría una verificación telefónica. Para simplificar y facilitar procesos, la base de datos de personal médico debería integrarse transparentemente con los sistemas de gestión de clientes (CRM) y transferir automática y diariamente las actualizaciones pertinentes, al tiempo que permitir a los usuarios de CRM solicitar actualizaciones de los datos de los profesionales para su validación – esto logra establecer una comunicación bidireccional que haga una realidad la precisión del dato en todo momento y resuelve muchos de los problemas relacionados con los datos, incluida la identificación de centros, especialistas y los vínculos entre ambos.
Conclusiones
Las compañías pueden beneficiarse de las recomendaciones de consultores externos para evaluar objetivamente sus sistemas de gestión de datos. Expertos en el manejo de datos pueden ayudar a identificar todas las fuentes de gasto a considerar y determinar cómo son de completas en cada uno de los sistemas. En el caso de que se encuentren problemas, pueden dar recomendaciones sobre cómo mejorar la calidad de los datos durante el proceso de recogida de los mismos. Ciertas soluciones tecnológicas en el mercado pueden ser utilizadas para identificar problemas en la calidad de la información recogida y corregirlos utilizando el dato más reciente y o completo para cada cliente.
Ya existen soluciones diseñadas específicamente para resolver la complejidad del proceso de Compliance en la industria de las ciencias de la salud. En un entorno cada vez más regulado, con constantes nuevas normativas, el riesgo de non-Compliance va en aumento. La buena noticia es que este riesgo puede ser convertido en una valiosa oportunidad.
Aquellas compañías que cuenten con las herramientas adecuadas podrán minimizar su riesgo al tiempo que maximizan sus activos.
En el actual contexto, incluso situaciones “menores” de non-Compliance o el no respetar los códigos deontológicos pueden derivar en significativas penalizaciones civiles, criminales, daños y perjuicios. El riesgo no sólo comporta denuncias, multas u otras sanciones. Las compañías arriesgan mucho más: su reputación y la confianza de sus clientes.
Aquellas organizaciones que apuesten por sistemas robustos podrán beneficiarse del incremento de la transparencia para causar impacto y mejorar su reputación. Existe una clara necesidad de fortalecer la confianza en la industria de las ciencias de la salud. Las compañías que puedan demostrar su fuerte compromiso con el proceso de Compliance y con altos niveles de transparencia en sus operaciones estarán bien posicionadas para reducir riesgos y mejorar su imagen pública.
Bibliografía
Industry Report: Achieving Transparency Worldwide, Cegedim http://crm.cegedim.com/Docs_Reports/Compliance/2012_European_Trends_Compliance_Report.pdf
The International Conference on Pharmaceutical Medicine & the Annual Meeting of AMIFE Nov, 2012 Newsletter 4. http://www.amife2012.com/mailing/news4/newsletter4.htm)
APBI, Association of the British Pharmaceutical Industry article PM Live http://www.pmlive.com/pharma_news/pharma_paid_uk_healthcare_professionals_40m_in_2012_470112
Cegedim Análisis Enero 2013: Gastos Promocionales Farmacéuticos: Tendencia global http://crm.cegedim.com/newsletters/insights/Documents/pharmapromospend.html
Lectura recomendada
2013 US Aggregate Spend Study – April 2013 http://crm.cegedim.com/featured/us-compliance-trends-2013/Documents/index.html
2012 Asia-Pacific Trends in Aggregate Spend, Transparency and Disclosure – November 2012 http://crm.cegedim.com/Docs_Reports/CRM/2012-APAC-Compliance-L.pdf
2012 US Pharma Insights – November 2012 http://crm.cegedim.com/Docs_Whitepaper/Industry/2012_US_Pharma_Insights_Report.pdf
2011 EU Market Access Survey White Paper - June 2011 http://crm.cegedim.com/Docs_Whitepaper/Data/EU_Market_Access_Survey_Rpt_June_2011.pdf
2011 European Trends & Challenges in Customer Data Management within the Life Sciences Industry- June 2011http://crm.cegedim.com/Docs_Whitepaper/Data/EU_Cust_Data_Mgmt_Survey_Rpt_June_2011.p

















