La publicación de los resultados obtenidos durante la investigación clínica de un fármaco en revistas médicas incrementa la confianza que siente el facultativo a la hora de prescribirlo. La industria farmacéutica debe estar comprometida con la publicación de todos los resultados que obtiene a través de la investigación clínica de una forma objetiva, rigurosa, honesta y en el menor tiempo posible.
En la actualidad, el profesional sanitario demanda una gran cantidad de información acerca de los fármacos comercializados, no solo en cuanto a su eficacia, sino también en relación con la efectividad y seguridad que muestran en las distintas poblaciones a las que se enfrenta en su práctica clínica diaria, y que en muchos casos quedan excluidas de los ensayos clínicos que realiza la industria farmacéutica. Es por ello que esta demanda de información no se limita a conocer los resultados de eficacia obtenidos en los ensayos clínicos que permiten conseguir la autorización de comercialización del fármaco, sino que se amplía a los resultados obtenidos en otro tipo de estudios, no necesariamente prospectivos, aleatorizados o controlados. Es en este otro tipo de estudios en los que se puede obtener información muy útil acerca del perfil de seguridad del fármaco en poblaciones especiales o con distintas morbilidades, de su efectividad en la práctica clínica real, del impacto que ocasionan en la calidad de vida del paciente, así como del balance coste-beneficio y coste-utilidad que se espera obtener, entre otros aspectos. Por tanto, cuanta más información científica exista sobre un fármaco y cuanto más accesible sea esta información, mayor será la confianza que sienta el facultativo a la hora de prescribirlo. En este sentido, la publicación de los resultados obtenidos durante la investigación clínica de un fármaco, además de ser un requisito ético y moral, puede ser una de las mejores herramientas de marketing farmacéutico que existen en la actualidad.
Las bases éticas para la investigación médica en humanos se establecieron por primera vez en la Declaración de Helsinki de 1964. En la revisión que tuvo lugar en Edimburgo en el año 2000, ya se incluía además la obligación de publicar los resultados obtenidos en todas las investigaciones clínicas realizadas, tanto si confirmaban como si rebatían la hipótesis inicialmente planteada. En este sentido, y con el objetivo de mejorar la publicación de resultados, desde hace algún tiempo el Comité Internacional de Editores de Revistas Médicas (ICMJE) aconseja a los editores de revistas científicas que exijan el registro previo de ensayos clínicos prospectivos en una base de datos pública y de acceso gratuito como primera condición antes de aceptar la publicación de resultados en cualquier revista. El ICMJE no recomienda ninguna base de datos en concreto, pero sí menciona que dicha base de datos debe permitir la realización de búsquedas electrónicas. De esta forma, a la hora de evaluar los resultados publicados de un fármaco en una situación clínica determinada, el profesional sanitario puede saber qué otros estudios están evaluando o han evaluado esa misma cuestión, cuáles han publicado sus resultados hasta el momento y cuáles no lo han hecho. Además, teniendo en cuenta las fechas en las que se empezó y finalizó la investigación, y que se deben especificar durante el registro del estudio en la base de datos, se puede deducir si ha existido tiempo suficiente para que el promotor y los autores publiquen los resultados obtenidos.
Hasta hace unos años, la falta de publicación de resultados de un ensayo clínico se justificaba con el argumento de que las revistas científicas eran más proclives a publicar resultados cuando éstos eran positivos (es decir, cuando confirmaban la hipótesis inicial) que cuando los resultados eran negativos.
Sin embargo, hoy en día este argumento ya no es válido. La base de datos americana ClinicalTrials.gov, aparte de indexar todas las publicaciones que aparecen en PubMed relacionadas con los estudios que tiene registrados a través del identificador NCT de forma automática e independiente al promotor de la investigación, permite incluir en su página web un resumen con los resultados más importantes del estudio, facilitando de este modo su difusión pública.
Por tanto, es clara la necesidad de publicar por una u otra vía los resultados obtenidos en ensayos clínicos prospectivos, pero ¿qué ocurre con los estudios no prospectivos?. Para contestar a esta pregunta, se debe tener en cuenta que en la actualidad la mayoría de las decisiones que se toman en el ámbito de la salud se fundamentan en criterios de evidencia que evitan el uso inadecuado e ineficiente de los recursos existentes. Esta práctica, denominada Medicina Basada en la Evidencia, conlleva la búsqueda sistemática de información científica y la evaluación crítica de la misma forma que, junto con la experiencia clínica del médico y las preferencias del paciente, se facilite la toma de decisiones en la práctica clínica diaria. Para definir el nivel de evidencia se pueden utilizar distintas escalas, pero todas ellas tienen en común que otorgan el mayor nivel de evidencia a los resultados obtenidos a través del meta-análisis de ensayos clínicos aleatorizados, seguido por los resultados de ensayos clínicos prospectivos aleatorizados, que se realizan en esa situación clínica. Por el contrario, el nivel de evidencia más bajo corresponde a documentos de consenso u opiniones de comités de expertos. Entre ellos, existen otros niveles de evidencia que, sin ser incontestables, pueden aportar al clínico información útil para la toma de decisiones en determinadas situaciones. En esta categoría, se incluyen los resultados de estudios prospectivos no aleatorizados, estudios de cohortes y estudios meramente descriptivos, prospectivos o retrospectivos, que incluyen a su vez los estudios de casos y controles. Por consiguiente, cualquier tipo de estudio de investigación clínica es capaz de generar evidencia, y solo por esta razón merece la pena intentar que sus resultados sean accesibles a toda la comunidad científica.
Una vez asumida la necesidad de publicar de una forma u otra los resultados de cualquier investigación clínica que se lleva a cabo, se debe elegir cuidadosamente el canal de comunicación que sea más idóneo. Hoy en día, existen pocos canales de comunicación entre la industria farmacéutica y el profesional sanitario que permitan informar por primera vez acerca de los resultados obtenidos en una investigación clínica. Entre ellos, se encuentran desde hace poco tiempo las bases de datos de ensayos clínicos, como se ha comentado con anterioridad, pero también los congresos médicos y las revistas científicas. Sin embargo, de todos ellos, la revista científica, ya sea de ámbito nacional o internacional, es el único canal que garantiza que la información que contiene el artículo original ha sido previamente revisada y validada por uno o varios expertos en la materia.
Es por ello por lo que en la actualidad se considera que la forma óptima de comunicar los resultados de una investigación clínica es como artículo original en una revista con un sistema de revisión por pares (Peer-Reviewed Journals). En la Figura 1, se observa como la publicación de resultados por parte de algunos de los mayores laboratorios farmacéuticos casi se ha triplicado en las últimas dos décadas. En la Figura 2, se observa como algunas de las especialidades farmacéuticas con mayor éxito de ventas a nivel mundial, tienen una extensa información científica disponible en revistas médicas, y como la publicación de resultados se acelera a partir de la aprobación de la especialidad para su comercialización. Sin embargo, son muchos los estudios cuyos resultados no llegan a ser publicados en este formato. Una de las razones que subyace a este problema es, sin duda, que la redacción y publicación de artículos originales en revistas nacionales e internacionales es un proceso largo y complejo.
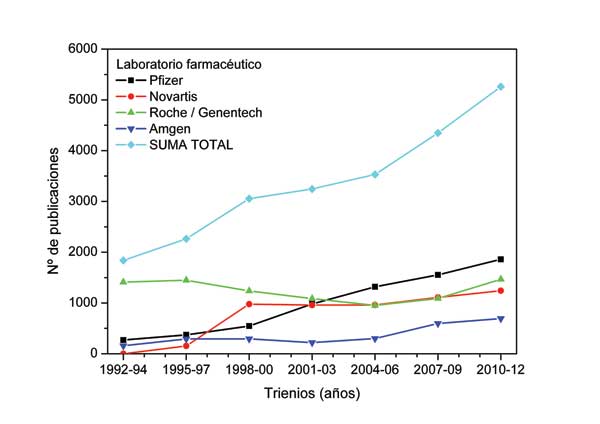
Figura 1. Publicación de resultados en revistas médicas por parte de algunos de los mayores laboratorios farmacéuticos durante el periodo 1992-2012.
*Estos datos provienen de la búsqueda avanzada realizada en PubMed, en la que en el campo “Affiliation” se han especificado los nombres de los laboratorios “Pfizer”, “Novartis”, “Roche o Genentech” y “Amgen” y en el campo “Date – Publication” se han especificado los años que aparecen en el eje de abscisas.
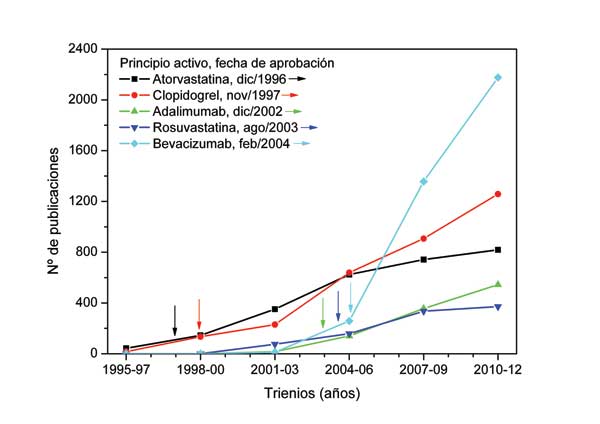
Figura 2. Publicación de resultados en revistas médicas de algunas de las especialidades farmacéuticas con mayores cifras de ventas a nivel mundial durante el periodo 1995-2012
*Estos datos provienen de la búsqueda avanzada realizada en PubMed, en la que en el campo “Title” se han especificado los principios activos “Atorvastatin”, “Clopidogrel”, “Imatinib”, “Adalimumab”, “Rosuvastatin” y “Bevacizumab” y en el campo “Date – Publication” se han especificado los años que aparecen en el eje de abscisas. Las fechas de aprobación de cada principio activo se han obtenido de la base de datos de la U.S. Food and Drugs Administration.
El éxito de una publicación científica depende en gran medida de lo legible y bien estructurado que esté el documento, independientemente de su valor científico o de la relevancia que tengan sus resultados. Desde hace tiempo, el redactor de textos médicos ejerce una función claramente establecida en el mundo sanitario y participa cada vez de forma más asidua en la comunicación de resultados de salud. Esto es así porque en general, cuando un redactor profesional participa en la comunicación de resultados de una investigación clínica, se incrementa la calidad de la comunicación en el formato que sea y se disminuye el tiempo necesario para conseguir su aceptación. Así, el redactor de textos médicos está especializado en redactar documentos científicos complejos de forma clara, concisa y estructurada, y transmitir mensajes clave de forma efectiva y coherente con una estrategia de comunicación global. Además, la intervención del redactor de textos médicos en la comunicación de resultados de salud es habitualmente muy apreciada, tanto por el investigador, como por el promotor de la investigación. El investigador ahorra mucho tiempo cuando recibe un borrador de manuscrito de calidad, que ya incluye sus indicaciones iniciales y que solo deberá revisar y matizar a su criterio. El laboratorio promotor, que legítimamente quiere rentabilizar al máximo la duración limitada de las patentes de su producto, consigue acelerar la comunicación de los resultados obtenidos a la comunidad científica a través de un canal óptimo, que genera una confianza máxima en el público al que va destinado. Por todo ello, la participación de un redactor de textos médicos mejora y acelera la comunicación de resultados de salud.
Sin embargo, hay dos puntos relevantes que se deben tener en cuenta. El primero es que el redactor de textos médicos debe trabajar en estrecha colaboración con el promotor y el investigador principal del estudio, para entender desde el principio por un lado el diseño y objetivos de la investigación, y por otro, las implicaciones clínicas que tienen los resultados obtenidos. El segundo punto que hay que tener en cuenta es que hay que maximizar la transparencia de todo el proceso, por lo que en el apartado de Agradecimientos se debe mencionar a todos los colaboradores que han participado en la investigación, pero que no cumplen los requisitos necesarios para ser autores de la publicación. Entre estos profesionales, se pueden encontrar el estadístico, el responsable de la monitorización, el redactor de textos médicos y el promotor que ha financiado el proyecto. Hoy en día, la mayoría de los proyectos de investigación son lo suficientemente complejos como para que sea necesaria la participación de profesionales externos, y reconocerlo así en la publicación incrementa la credibilidad de los resultados que se están comunicando.
Como conclusión, la industria farmacéutica debe estar comprometida con la publicación de los resultados que obtiene a través de la investigación clínica de una forma objetiva, rigurosa, honesta y en el menor tiempo posible. Sin duda, este compromiso mejora el conocimiento del fármaco y minimiza la posibilidad de defraudar al profesional sanitario que lo prescribe y a la sociedad en su conjunto.















