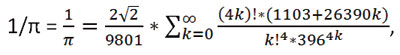Con el único ánimo de provocar al lector –obviamente para recabar su interés en el mundo de la modelización y su utilidad-, podemos empezar preguntándonos cuál es el valor del número π. Si Vd., lector, responde que es 3,14 le tendré que decir que la respuesta no es correcta.
Ese valor no expresa correctamente el del número π. Es tan sólo una aproximación. Si hubiera respondido 3,14159265358979 le tendría que responder nuevamente que no es correcto. La respuesta es π ≈ 3,14, es decir, π es aproximadamente 3,141592…. Eso sí, en su segunda respuesta, el lector se habría acercado más al valor real, porque ambas respuestas no son más que aproximaciones a una realidad que desconocemos. Muchos investigadores han analizado este simple problema, ofreciendo una gran variedad de abordajes matemáticos. Así, ya desde el antiguo Egipto –hace unos 2.000 años-, se afirmaba que el área del círculo (S) era similar a la de un cuadrado cuyo lado es 8/9 de su diámetro (d), es decir, S = π*r2 = [(8/9)*d]2, por lo que π = [(8/9)2*(2r)2], y en definitiva, π = 256/81, cuyo resultado es 3,16049. Arquímedes y Ptolomeo nos llevaron a mejores aproximaciones al conocido 3,1416… Y ya, en 1910, Srinivasa Ramanujan describe otra fórmula algo más compleja:
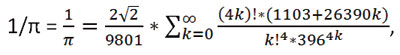
y cuyo resultado es 3,14159265… y que otros investigadores han demostrado, en 1985, que es correcto. En realidad, tampoco es correcto… pero está más cerca de serlo. Más recientemente, en 2011, Alexander Yee y Shigeru Kondo han calculado los 10 primeros billones de decimales del número π. Ciertamente, una magnífica aproximación a la realidad de un número irracional que, como tal, no completaremos nunca.
De la misma forma, un modelo no es más que un conjunto de relaciones que se utiliza para analizar, de una forma simplificada, una realidad compleja e imposible de abarcar en su totalidad. Por tanto, siempre será una aproximación a dicha realidad. No debemos empecinarnos en alcanzar la verdad absoluta. Eso sí, necesitamos un método de acercamiento a esa realidad lo suficientemente válido como para analizar adecuadamente el problema al que nos enfrentamos y poder tomar decisiones. Por ello, George Box, estadístico recientemente fallecido, pronunció la famosa sentencia “All models are wrong, but some are useful”. Así, si deseamos estimar la superficie de un gran terreno circular de 650 km de radio, la aplicación del modelo egipcio ofrecería un valor de 1.335.307 km2. Sin embargo, el de Ramanujan lo estimaría en 1.327.323 km2. Una diferencia de 7.984 km2. Por tanto, si deseáramos adquirir dicho terreno, a un precio de 2.000 €/km2… ¡hubiéramos pagado unos 16 millones de euros más! Pero, incluso así, el modelo egipcio habría ofrecido una estimación aproximada de una realidad que desconocemos por lo que, en una primera fase, incluso siendo erróneo, nos hubiera resultado de gran utilidad.
La investigación de fármacos es una tarea ardua, difícil, compleja, que sólo ofrece sus frutos después de muchos años y que, en ocasiones, dichos frutos no son satisfactorios, haciendo inútil todo el esfuerzo desempeñado hasta ese momento.
Imaginemos por un momento que, cuando se inicia un costosísimo ensayo clínico de fase 3, disponemos ya de cierta información obtenida en la realización del anterior estudio de fase 2 –a pesar de que dicha información fuera semejante a la ofrecida por el modelo antiguo egipcio- que nos augura que el resultado se situará sobre los 1.300.000 unidades, con un rango de ±100.000. Supongamos asimismo, que se necesita obtener un resultado mínimo que supere el valor de 2.500.000 unidades para alcanzar una eficacia y eficiencia suficientes para lograr una posición en el difícil mercado farmacéutico. Con esa información en nuestro poder –repito, aunque groseramente aproximada - la decisión de iniciar el estudio fase 3 hubiera sido negativa. De este modo, la utilización de modelos en los primeros estadios de la investigación de un fármaco permite obtener información de una gran relevancia para la posterior toma de decisiones del tipo go – no go (Figura 1).
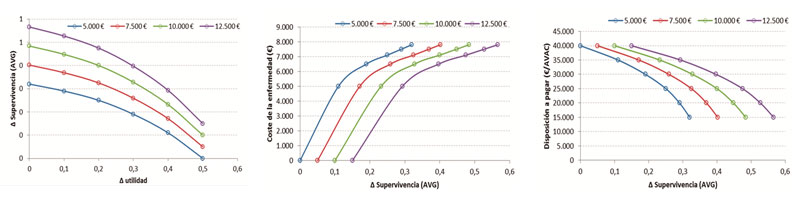
En fases más avanzadas, como las situadas en las postrimerías de los ensayos clínicos de fase 3, la utilización de modelos nos acerca más a esa realidad desconocida. En esos momentos se dispone ya de una información más fina respecto, por ejemplo, del incremento medio de la supervivencia, de la variación estimada de la calidad de vida o del coste del manejo de la patología evaluada1. La inclusión de dichos datos en complejos modelos nos ofrece ya una estimación más clara del nivel de eficiencia del fármaco investigado. Combinando estos resultados con las diversas disposiciones a pagar –en función del tipo de innovación, del valor aportado, de la disponibilidad de alternativas, de la situación del paciente respecto a su esperanza de vida, etc.- se puede estimar un rango de precios, potencialmente adecuados para todos los actores que intervienen en el posterior escenario de la toma de decisiones sobre el precio adjudicado al fármaco y la financiación pública del mismo.
Pero, incluso una vez notificado un precio oficial y una decisión positiva sobre la financiación por el Sistema Nacional de Salud, quedan por resolver otros escenarios que no han sido analizados previamente. La inclusión del nuevo fármaco en una determinada comunidad autónoma pasa por la demostración de que el mismo es eficiente y abordable en dicho ámbito geográfico. El anterior modelo, que ya gozaba de una información suficiente para acercarse más a la incierta realidad, puede ser retomado para estimar el nivel de eficiencia en su nuevo escenario y, principalmente, el impacto que su inclusión producirá en esa Comunidad. Tan importante es este paso, que muy recientemente se han publicado unas normas que regulan la forma en que debe presentarse la información específica, estimada habitualmente del ajuste de los modelos a las peculiaridades de dicha Comunidad Autónoma2.
Todo lo dicho hasta este momento, se refiere a la eficiencia derivada de los resultados en pacientes que se hallan en el seno de un ensayo clínico. Es sabido que, en este caso, dispondremos solamente de valores de eficacia y no de aquellos que pueden esperarse de la utilización del fármaco en la práctica clínica cotidiana, es decir, de efectividad. No obstante, nuevamente los modelos nos permiten estimar - como ya hemos reiterado, mediante una aproximación a la realidad - los resultados habidos cuando ciertas variables relevantes son modificadas. Cómo variaría el resultado si el grado de cumplimiento terapéutico en la práctica cotidiana es inferior al observado en el ensayo clínico. O qué variación sufriría el resultado clínico en el conjunto de los pacientes si la incidencia de efectos adversos que conduce al abandono fuera superior o inferior a la previamente observada. O bien, cómo repercutiría en la eficiencia del tratamiento, la aplicación de nuevos procedimientos diagnósticos o test de laboratorio que fueran aplicados en los pacientes, probablemente mejorando el control de la patología pero aumentando ese coste concreto. Todos ellos constituyen nuevos escenarios que deben ser conocidos pero que, en este momento, presentan un alto grado de incertidumbre. Las decisiones tomadas ya en la vida real, fuera de las estrictas pautas del ensayo clínico, deberán estar basadas en elementos de juicio que difieran poco de sus valores reales. En este caso, el análisis mediante la utilización de modelos de potenciales escenarios - diferentes al evaluado en la fase de investigación -, forma parte de otra interesante aplicación de aquéllos.
Finalmente, un aspecto de gran importancia en la actualidad lo constituye la determinación del adecuado posicionamiento terapéutico basado en la eficiencia del nuevo fármaco. Cada vez se conoce más acerca de las diversas patologías. Lo que hace pocos años se consideraba como patología única – digamos el cáncer de mama -, hoy se sabe que se trata de un conjunto de patologías, incluso bastante diferentes, que precisan de tratamientos diferentes; del mismo modo, un mismo fármaco puede no presentar la misma eficacia en cualquier tipo de paciente. Variables como edad, riesgo inicial, tiempo de evolución de la patología, nivel de gravedad de la misma, etc. son elementos que modulan de forma significativa el resultado de eficacia y, por tanto, el de eficiencia. El análisis de subgrupos representa una forma idónea de designar adecuadamente los tipos de pacientes en donde el nuevo fármaco presentará un valor máximo, diferenciándose de los demás. Y, como el lector habrá ya supuesto, la utilización de los modelos nuevamente contribuye a aportar más luz para la correcta toma de decisiones.
Para concluir, es cierto que no se puede pretender que los modelos sean la panacea para cualquier problema de incertidumbre. Volviendo al inicio, todos son aproximaciones erróneas e insuficientes. Pero también es cierto que la toma de decisiones sin disponer de elementos de juicio suficientes presenta una mayor probabilidad de ser inadecuada. Los recursos sanitarios son –casi por definición- ilimitados y escasos; la decisión sobre la asignación de los mismos debe conducir a la obtención del mejor resultado, el más eficaz y eficiente. El acercamiento a una realidad que aún no se conoce, mediante la utilización de modelos, constituye así un camino apropiado. Por ello, algunos modelos resultan útiles para dicho fin.
1) Sanz Granda, A. ¿Vale lo que cuesta? Qué ha de tener el nuevo fármaco para ser incorporado en la Guía Farmacoterapéutica. Majadahonda. Editorial ERGON, 2007.
(2) Puig-Junoy J, Oliva-Moreno J, Trapero-Bertrán M, Abellán-Perpiñán J, Brosa-Riestra M y Servei Català de la Salut (CatSalut). Guía y recomendaciones para la realización y presentación de evaluaciones económicas y análisis de impacto presupuestario de medicamentos en el ámbito del CatSalut. Generalitat de Catalunya. Departament de Salut. Servei Català de la Salut: Barcelona, 2014.