"En el futuro, antes que un médico le prescriba un medicamento, le hará una extracción de sangre, la analizará en un laboratorio cercano e identificará cual de, vamos a decir 12 medicamentos posibles, será el que podrá tratarle con mayor eficacia y con mínimos efectos secundarios"
Allan D. Roses, responsable de la investigación genética mundial de GlaxoSmithKline.
Estado actual de la Farmacología
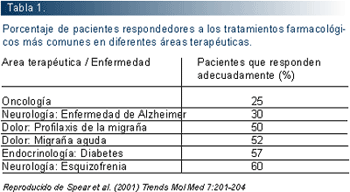
A unque los medicamentos se han demostrado eficaces y seguros antes de su autorización, la variabilidad en la respuesta a los medicamentos de los pacientes es la regla y no la excepción. La comunidad médica conoce bien que no es generalizable el hecho que un medicamento a una dosis determinada, que funciona bien para un paciente determinado, lo vaya a ser para otro paciente (ver tabla 1). Los informes de la OMS ratifican esta afirmaciones:
-Que existe una terapia farmacológica adecuada sólo para una cuarta parte de las enfermedades.
-Que dos tercios de los pacientes tratados con esa terapia "adecuada" alcanzan el beneficio esperado. El tercio restante no sólo no lo alcanza, sino que puede experimentar reacciones adversas. Algunos ejemplos concretos pueden observarse en la tabla 1.
-Las reacciones adversas a medicamentos es una de las seis causas mayores de muerte en países como Estados Unidos, representando las graves el 6,7% (2.216.000 personas en 1994) y las fatales el 0,32% (106.000 personas en 1994).
De la prescripción prueba-error a la medicina personalizada
Hoy en día, los pacientes esperan recibir un tratamiento personalizado a su enfermedad. Aun así, cuando un paciente es visitado por su doctor y éste último decide la prescripción de un medicamento, el acto de la prescripción se suele guiar por criterios reduccionistas. Estos criterios suelen estar basados frecuentemente en la evidencia científica reportada sobre la población general en los ensayos clínicos de los medicamentos, pero también en su propia experiencia y percepción respecto a la tasa de respuesta del medicamento en su población de pacientes. La prescripción de un tratamiento farmacológico no es una decisión fácil cuando no hay marcadores biomédicos que permitan discriminar entre un tratamiento u otro, y en la mayoría de los casos la decisión está basada en la única estrategia posible del "prueba y error". Por lo que el tratamiento se suele prescribir según el criterio y percepción del médico, de cuál es el mejor tratamiento según su experiencia.
Es conocido que la variabilidad en la respuesta a un medicamento depende de diferentes factores ambientales (cumplimentación terapéutica correcta, edad, sexo) más o menos fáciles de controlar, pero que generalmente no explican la mayor parte de esta variabilidad. Existe una amplia evidencia publicada en la que se demuestra que las variaciones interindividuales en la eficacia y toxicidad de los medicamentos están determinadas principalmente por factores genéticos. La comprensión del mecanismo molecular de la acción del medicamento y los determinantes genéticos de la respuesta al mismo deberían permitirnos optimizar el uso de muchos medicamentos. Este entendimiento a nivel molecular, nos puede permitir plantear como objetivo proporcionar el medicamento correcto a la dosis adecuada al paciente idóneo y en el momento oportuno, o sea, hacer medicina personalizada.
Para ello es necesario el cambio de paradigma actual. El paradigma de las últimas décadas de "una dosis de un medicamento para todos los pacientes" está siendo cuestionado para generar un nuevo paradigma basado en "un medicamento indicado a la dosis correcta para el paciente indicado". Apoyando este nuevo paradigma reaparece la Farmacogenética como una disciplina central que permita racionalizar los tratamientos farmacológicos basados en las características intrínsecas (genéticas) del paciente.
Farmacogenética y Farmacogenómica
La Farmacogenética es una disciplina con más de 50 años de trayectoria, revitalizada con la revolución del descubrimiento de la secuencia del Genoma Humano y su aplicación a las ciencias biomédicas. La Farmacogenética estudia el componente genético y las interacciones genético-ambientales que determinan la respuesta de los pacientes a los medicamentos. Por otra parte la utilización de tecnologías genómicas aplicadas a los medicamentos (Farmacogenómica) permiten realizar los estudios de las bases genéticas y moleculares de las enfermedades con el objetivo de identificar nuevas dianas terapéuticas para su tratamiento.

Reproducido de Veenstra e Higashi, AAPS Pharmsci 2 (3) article 29. http://www.pharmsci.org
Ambas disciplinas están siendo incluidas progresivamente por la industria farmacéutica en el desarrollo de nuevos medicamentos gracias al rápido crecimiento de los conocimientos de los genes que componen el genoma humano y la variabilidad en ellos (conocidos como polimorfismos genéticos). El descubrimiento de nuevas variaciones genéticas en los genes permite estudiar el impacto de los diferentes polimorfismos genéticos en la eficacia y toxicidad de los medicamentos. Desde un punto de vista farmacológico representarían el estudio de los polimorfismos genéticos de los genes implicados en los mecanismos ADME del medicamento (absorción, distribución, metabolismo, excreción) y los genes que codifican para las dianas terapéuticas.
Indicación de la Farmacogenética
Los análisis genéticos en los que se basa la Farmacogenética son en la actualidad práctica clínica habitual para el diagnóstico de ciertas enfermedades (cáncer, esclerosis, neurodegenerativas, psiquiatría, hipercolesterolemia, ...), y aunque el coste de realizar las determinaciones genéticas están disminuyendo día a día, debido a los avances tecnológicos y automatización de procesos derivados del Proyecto Genoma Humano, estos análisis aún suponen un coste elevado para ser aplicados al tratamiento de cualquier enfermedad.
Así se ha priorizado, sobre la base de criterios de coste-efectividad, las áreas en las que primero se implantarán los conocimientos farmacogenéticos (ver tabla 2). Es evidente la necesidad de tener los tratamientos adecuados a cualquier precio en aquellas enfermedades donde el tratamiento inmediato no adecuado pone en peligro real la supervivencia del individuo (cáncer, SIDA, neurodeneración, enfermedad cardiovascular, ...), aumentan con el tiempo el nivel de pronóstico degenerativo (Alzheimer, EPOC, esclerosis, artrosis,...), o que afecten gravemente a la calidad de vida (enfermedades psiquiátricas), en aquellos tratamientos farmacológicos, que siendo indicados, puedan implicar la aparición de reacciones adversas, o en enfermedades con tratamientos caros (por motivos de coste efectividad del tratamiento). Con el abaratamiento de los análisis genéticos, el margen de las indicaciones de la Farmacogenética es previsible que se vaya ampliando progresivamente hasta poder convertirse, de acuerdo con las predicciones de Allen Roses, en algo tan rutinario hoy en día como un análisis serológico.
Farmacogenética y desarrollo clínico
Un objetivo principal en el desarrollo de los nuevos medicamentos por parte de la industria farmacéutica es el de mejorar los perfiles de eficacia y seguridad de los nuevos tratamientos. La inclusión de la Farmacogenética puede tener un papel principal en la identificación de qué perfiles de los pacientes influyen en la dosificación necesaria para tener una respuesta óptima y segura al tratamiento. En la figura 1 se muestra cómo se enmarcará la Farmacogenética en el proceso de desarrollo de cualquier medicamento: En la fase I de investigación, se podrán identificar los perfiles de los pacientes no respondedores o los que puedan sufrir reacciones adversas frecuentes, esta información podrá ser utilizada para desarrollar estudios de Fase II de pacientes en el que funcione bien el medicamento, y posteriormente diseñar estudios de Fase III de menor tamaño, más rápidos y eficientes, que permitan la aprobación rápida por parte de los organismos reguladores para sujetos que presenten un perfil adecuado de respuesta al medicamento.
Farmacogenética y estudios de post-autorización
La Farmacogenética no sólo tendrá un impacto sobre el desarrollo de los nuevos medicamentos en fase de desarrollo, sino que es de interés para los medicamentos comercializados, para ampliar el conocimiento del medicamento incorporando datos de efectividad y de reacciones adversas asociados a los perfiles genéticos de una población de pacientes más heterogéneo, que el utilizado en las fases pre-autorización.
Este hecho, en entornos como el español, puede dar nuevas e interesantes perspectivas a los estudios de fase IV, recientemente reglamentados a través de disposiciones como el RD 711/2002 y la Circular 15/2002 de la Agencia Española del Medicamento.
Como indica la Circular 15/2002, en su anexo VI, referida a las directrices sobre estudios post-autorización de tipo observacional para medicamentos de uso humano, "Los estudios post-autorización se consideran necesarios para la obtención de un conocimiento que los ensayos clínicos controlados realizados durante el desarrollo clínico de los medicamentos no aportan. Dicho conocimiento es fundamental para orientar la práctica clínica y favorecer un uso racional de los medicamentos". Adicionalmente, el RD 711/2002 postula que "las administraciones sanitarias, en el ámbito de sus competencias, deben regular las condiciones por las que se realizarán dichos estudios, al objeto de favorecer los que tengan verdadero interés científico e impedir los que tengan un fin puramente promocional". En los últimos tiempos, a raíz de la promulgación de estas disposiciones ha habido una notoria caída en el número de estudios post-autorización. Simultáneamente, parece observarse un incremento en el número de estudios con objetivos farmacogenéticos.
La profusión de estudios con estas características en el ámbito español se ha reflejado en dos publicaciones que constituyen auténticas guías de evaluación de este tipo de estudios al nivel de los CEICs (Medicina Clínica, 2003 Jan 25; 120(2): 63-7 y Medicina Clínica, 2003 Feb 1; 120(3): 101-7). La lectura cuidadosa de estas guías sugiere que los estudios de post-comercialización con componente farmacogenético no sólo aportan información que permite "orientar la práctica clínica y favorecer un uso racional de los medicamentos" sino que sin duda aportarán una información de "verdadero interés científico" que tiene trascendencia tanto a ese nivel como a los no científicos. La necesidad de realizarlos para ampliar el cuerpo de conocimiento y que sean realizados por expertos, se pone de manifiesto claramente en estos trabajos.
El valor científico y la posibilidad de favorecer la racionalidad en el uso de medicamentos de los estudios farmacogenéticos, hacen que sean bien valorados por los Comités Éticos de Investigación Clínica (CEIC) en su evaluación de nuevos estudios de post-comercialización, y que tengan pocos problemas para ser autorizados por las administraciones sanitarias.
Así, estudios de fase IV multicéntricos, con componente farmacogenómico, ya sea en su objetivo principal, o como un objetivo secundario, en áreas terapéuticas diversas (cardiovascular, neurología, etc...) y utilizando las últimas tecnologías de entrada remota de datos, están siendo realizados en la actualidad en nuestro país con medios nacionales y mostrando que en este país también se puede hacer este tipo de investigación.
Una complejidad de estos estudios radica en el proceso de recogida de muestras para realizar los análisis genéticos. Existen diferentes metodologías de recogida de muestras, pero algunas de ellas se han demostrado fáciles de implementar y ejecutar por los médicos (tanto especialistas como de atención primaria) no requiriendo de grandes logísticas de conservación en frío, y que permiten la viabilidad de este tipo de estudios a costes aceptables para un número grande de pacientes.
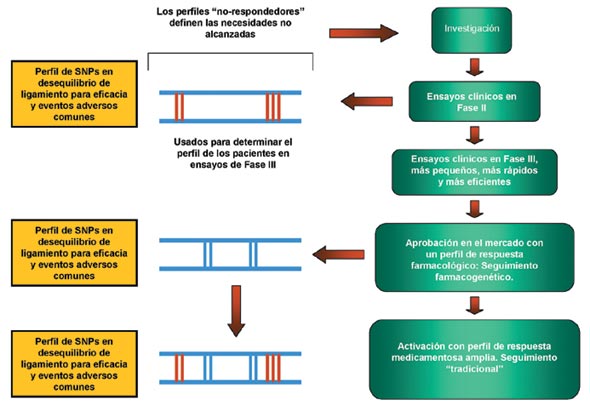
Reproducido de Roses. Nature. 2000 jun 15; 405 (6788):857-65
Implicaciones éticas de la Farmacogenética
Las implicaciones éticas de la Farmacogenética son menores que en el caso de los estudios genéticos, ya que los genes objeto del estudio de la Farmacogenética habitualmente no suelen estar implicados en el desarrollo o pronóstico de la enfermedad que origina el tratamiento con el medicamento. Aun así, este tipo de implicaciones existen en el terreno de la confidencialidad de los datos, ya que el componente genético es percibido en algunos sectores sociales como datos que pueden incidir a la discriminación. Al ser datos de carácter personal como pueden ser el nombre, edad, etnia o el sexo, recogidos habitualmente en los estudios clínicos, han de ser tratados según la normativa de protección de datos y detallado en los protocolos cómo se tratará y quiénes son los responsables del manejo de la información genética obtenida. Por otra parte, se ha de contemplar el derecho a saber, o no saber, de los pacientes respecto a si se descubre durante los estudios si tienen algún factor genético que les haga propensos a padecer una enfermedad en el futuro. Por lo que es necesario indicar los mecanismos para acceder a la información genética por parte del paciente. Existen otras implicaciones éticas de menor calado que se tendrán que tener en cuenta a la hora de diseñar el estudio. Estas dificultades debidas a las implicaciones éticas no suelen ser un problema para la autorización cuando han sido contempladas debidamente en el protocolo. Lo mejor es ponerse en manos de gente experimentada en estos territorios y mejor si ya tienen experiencia en estudios farmacogenéticos o genéticos.


















