|
Un alto nivel de actividad en desarrollo de negocio
La cantidad de acuerdos de licencia, colaboración o adquisición en el sector farmacéutico-biotecnología ha aumentado progresivamente en los últimos años.
El aumento en el número de acuerdos de licencia responde a una doble casuística:
- Disponibilidad de proyectos: Incremento de compañías en I+D sobre todo en el segmento de la biotecnología ofreciendo productos sobre todo en fases iniciales de desarrollo.
- Aumento de la demanda: Necesidad de las compañías farmacéuticas de renovar los portafolios con mayor rapidez debido al acortamiento de los ciclos de vida en parte provocados por la presión administrativa en precios.
El desarrollo de la biotecnología ha supuesto un cambio sustancial en la dinámica del sector farmacéutico generando un aumento de la oferta de productos así como al acortamiento de los plazos de lanzamiento con respecto a los productos farmacéuticos de origen químico.
En cuanto a la demanda por parte de las empresas farmacéuticas se ha producido por un marcado descenso del número de lanzamientos de nuevas sustancias.
A nivel internacional según IMS2 el número de nuevos principios activos comercializados en 2004 fue de 31 (30 en 2003). Estas cifras son claramente inferiores a los registrados en la década de los 90 (entre 40 y 50 por año). El 30% de los lanzamientos de 2004 fueron productos procedentes de Biotech.
Evolución de nuevos principios activos en España durante
los últimos años.
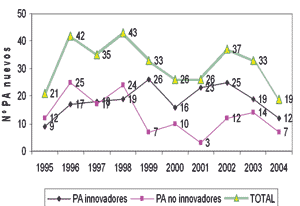
Fuente: Elaboración propia basado en Panorama Actual Med. 2005:
29 (enero-febrero):1-148
La media de nuevos principios activos entre 2000-2004 (28) ha disminui- do significativamente respecto a la media en el periodo 1995-1999 (35) confirmándose la tendencia descendente en la disponibilidad de nuevos principios activos en los últimos años.
Los grupos terapéuticos que registraron el mayor número de nuevos principios activos fueron SNC, Antineoplásicos y Anti-infecciosos según se muestra en la siguiente gráfica.
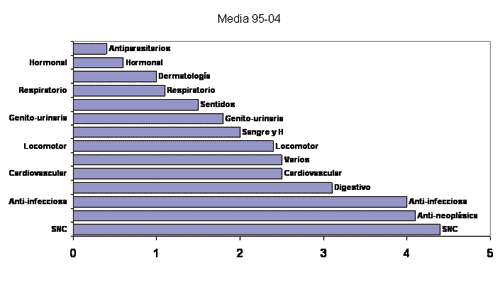
Fuente: Elaboración propia basado en Panorama Actual Med. 2005:
29 (enero-febrero):1-148
Nuevos principios activos en España (2005)
La gráfica siguiente representa el número de productos aprobados en España en el periodo entre enero y julio de 2005. Se observa claramente que el número de aprobaciones referidas a nuevos principios activos es muy inferior respecto al número total de aprobaciones.
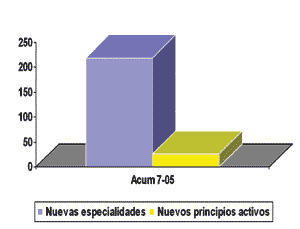
Fuente: Panorama Actual Med. 2005: 29 (julio-agosto). 637-756
Grado de innovación de los nuevos principios activos comercializados en España (2005)
Como dato adicional es importante destacar que el nivel de innovación
de los nuevos principios activos comercializados en 2005 (hasta julio 2005)
es considerado como “innovación moderada” en un 60% de los casos.
Nivel de innovación de los nuevos principios activos en España
Se entiende por 4: estándar.
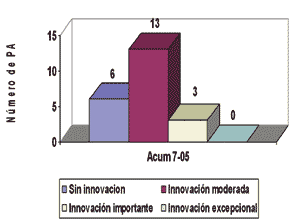
Fuente: Elaboración propia basado en Panorama Actual Med.
2005: 29 (julio-agosto):637-756
Se entiende por 4:
- Sin innovación: no implica ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas.
- Innovación moderada: aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar.
- Innovación importante: aportación sustancial a la terapéutica estándar.
- Innovación excepcional: cubre la ausencia de una alternativa terapéutica farmacológica (laguna terapéutica).
Resumen de nuevos principios activos aprobados en España 2004-2005

Fuente: Elaboración propia basado en Panorama Actual Med. 2005: 29 (enero-febrero):1-148 y Panorama Actual Med. 2005: 29 (julio-agosto):637-756
Mayor peso de los productos procedentes de licencias:
Todas las compañías farmacéuticas incluyendo las grandes multinacionales dependen cada vez más de las licencias para completar o construir los pipelines y portafolios de productos.
Como hemos discutido en anteriores artículos, la demanda creciente responde a varios factores internos y externos entre los que destacan:
-
Una falta de productos disponibles en los pipelines internos
-
Una gran necesidad de renovación rápida del portafolio
-
Una necesidad de productos con alto nivel de innovación que permitan acceder a precios más altos
Varios estudios estiman que en torno al 20% de las ventas actuales de las grandes farmacéuticas proceden de productos de licensing-in estimándose que esta cifra será en torno al 40% en el periodo 2007-2009. El licensing es una importante fuente de ingresos y será aún más relevante en el futuro.
Algunas top-10 ofrecen en sus apartados de I+D la siguiente información sobre el pipeline:
-
PFIZER: muestra una larga historia de éxitos en Deal-making. Un total de 34 productos principales en pipeline proceden de licencias de los cuales 16 ya han sido comercializados
-
GSK: 140 productos de pipeline en fase clínica y 50 acuerdos de I+D en marcha en diversas áreas terapéuticas.
-
Novartis: 17 nuevas sustancias previstas para presentación hasta 2008. 67 productos en pipeline (fase I a pre-aprobación) Actualmente gestionan 290 colaboraciones (tecnológicas o pre-clínica) en 17 países 90 de ellas con compañías de biotech.
-
Sanofi-Aventis: 128 productos en desarrollo. 77 en pre-clínica y fase I y 58 en fases II-III.
-
AstraZeneca: 50 nuevos productos en preclínica-fase I y 14 en fase II-III. A finales de 2004 había 1700 acuerdos de colaboración con universidades y empresas de biotecnología para completar el I+D interno.
-
BMS: las ventas procedentes de alianzas en 2003 fueron > 50% del total (20.9 billion USD ventas netas totales). Actualmente tienen 50 compuestos en I+D de los cuales 10 están en fases finales de desarrollo.
Cambios en los tipos de acuerdo:
Además de observarse un aumento en el número de acuerdos de licencia, se observa también en los últimos años un cambio en el tipo de productos objeto de dicha licencia. Anteriormente los acuerdos de licencia se daban en las fases avanzadas de desarrollo. En los últimos años ha aumentado considerablemente el % de acuerdos de licencia firmados en fases tempranas del desarrollo (fase I-fase II). Esta tendencia se ha visto impulsada por los siguientes factores:
-
La entrada de la biotecnología con proyectos de alto potencial e innovación pero en estadios todavía tempranos y desarrollados generalmente por compañías de pequeño tamaño con poca capacidad financiera para desarrollar los proyectos en solitario.
-
La alta competencia de las empresas farmacéuticas por hacerse con los proyectos de alto potencial. Las empresas prefieren reservarse cuanto antes los derechos de los productos innovadores bloqueando así la entrada de otras compañías en fases más avanzadas.
-
El precio más asequible de los proyectos en fases tempranas debido a tener asociado lógicamente un mayor riesgo de fracaso permitiendo a las compañías tener mayor diversificación de proyectos con menor coste medio resultando en una mayor rentabilidad global.
Esta situación se refleja por ejemplo en la actividad de partnering desarrollada en foros de biotecnología internacionales donde sólo un 7% de la oferta de licencias corresponde a productos en fases avanzadas (fase III, pre-registro o comercializado). Los productos que están en fases más avanzadas ya están “comprometidos”.
Cambios en la estructura económica de los “deals”:
La firma de acuerdos en fases tempranas junto con el descenso de rentabilidad del I+D interno (debido a la presión económica de las autoridades sobre las compañías farmacéuticas principalmente a través de la limitación de precios en productos nuevos y antiguos) han provocado un necesario cambio en la estructura económica de los acuerdos destacando las siguientes tendencias:
-
Compartir el riesgo de los proyectos siendo mayor el % de fees pagados en función de milestones o de royalties reduciéndose por tanto las cantidades pagadas como up-front payments.
-
Una parte importante del pago es en forma de inversión en las empresas propietarias (compra de acciones con premium price)
-
Aumenta el % de co-inversión en I+D (pagos directamente dedicados a asegurar el rápido y existoso desarrollo del producto).
Mayor peso del componente variable: Royalties y milestones
El componente variable de los acuerdos está aumentando progresivamente en los deals tal como hemos visto como una forma de asegurar los derechos de productos para completar un pipeline pero evitando al mismo tiempo los riesgos asociados a las fases iniciales de desarrollo. Se muestra a continuación las probabilidades de obtener la aprobación por FDA en productos que están comenzando la fase de desarrollo:
Probabilidad de aprobación por FDA de los compuestos que inician la fase de desarrollo según área terapéutica
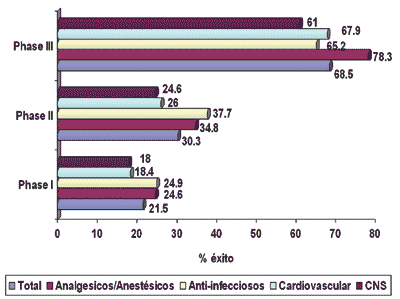
Fuente: H.G. Grabowski (with DaMasi, J. and Vernon, J.), R&D Costs and Returns by Therapeutic Category, Drug Information Journal (2004).
Estos datos justifican enormemente la variabilización de los pagos así como el compartir los riesgos y beneficios del producto a licenciar en fases tempranas.
El Royalty es una herramienta que responde a estas necesidades y que resulta muy confortable para las compañías, al menos en el momento de firmar el acuerdo.
A la hora de fijar los % de royalty se han de tener en cuenta varios parámetros que orientarán a las cifras hacia uno u otro rango:
-
Territorios
-
Grado de exclusividad
-
Potencial de ventas
-
Grado de innovación
-
Nivel de competencia esperado en el momento del lanzamiento
-
Fase de desarrollo
-
Nivel de encaje estratégico en el pipeline
-
Reparto de responsabilidades y costes en I+D, registro y fabricación.
-
Rentabilidad esperada del producto: nivel de inversiones en marketing y ventas necesarios para alcanzar las ventas esperadas.
Los rangos de royalty son por tanto muy variables dependiendo del tipo de acuerdo y del tipo de producto. Alguna publicación internacional ha realizado estudios sobre los % de royalties incluidos en acuerdos de licencia. A pesar de que los royalties han de ser establecidos en cada caso particular podemos tener una orientación sobre la media de royalties en la industria que se sitúa en los siguientes rangos:
-
Pre-clínico: 0 a 5%
-
Fase I: 5-10%
-
Fse II: 8-15%
-
Fase III: 10-20%
-
Productos comercializados: igual o superior a 20%
Otra de las herramientas muy valiosas y en aumento son los pagos por milestones. El asociar los pagos al cumplimiento de determinados eventos y al avance del producto hacia la aprobación del producto y su consiguiente comercialización.
Los eventos que se suelen asociar al milestone son entre otros:
-
Inicio y finalización de las fases de desarrollo (pre-clínica, fase I, fase II, fase III)
-
Presentación del registro
-
Autorización de comercialización en cada territorio
-
Aprobación del reembolso y precio
-
Lanzamiento
-
Alcanzar determinado nivel de ventas.
Ingredientes de un buen proceso de licencia
Dentro de este entorno cambiante donde hay muchas empresas que se mueven rápidamente es importante no perder oportunidades de negocio pero al mismo tiempo es básico realizar unas inversiones bien analizadas.
Como orientación básica de los ingredientes que consideramos imprescindibles en Axis Pharma para la consecución de un éxito a largo plazo exponemos a continuación las fases y procedimientos utilizados en Axis Pharma:
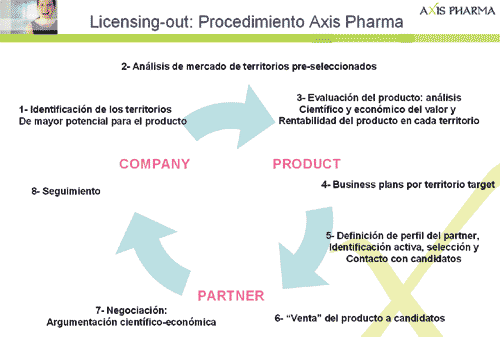
Proceso en licensing-out
Cada etapa aquí resumida implica una fuerte carga de trabajo y requiere en la mayoría de los casos varios meses años de trabajo y dedicación. Aquí se ha presentado un esquema resumido de los pasos fundamentales pero hemos de tener en cuenta que cada una de estas etapas contiene en si misma un plan completo de actuación así como unas sub-etapas de las que no es objeto hablar en este artículo. Sin embargo dan una idea del esfuerzo necesario sobre todo cuando se quiere gestionar el proceso de forma organizada y sistemática.
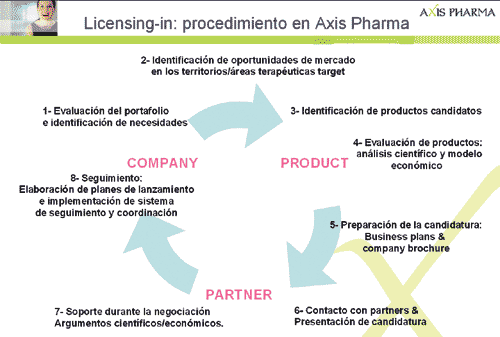
Etapas en un proceso de Licensing-in:
En el caso del Licensing-in existe una complejidad añadida que podemos resumir en “separar el polvo de la paja”. Esta diferencia añade complejidad y carga de trabajo durante el proceso.
Conclusiones
El sector farmacéutico ha sido tradicionalmente un sector lento donde los cambios se materializaban de forma casi imperceptible. En los últimos años se está produciendo un proceso de aceleración del sector que afecta entre otras áreas al desarrollo de negocio y las licencias.
La escasez de productos nuevos unido a este nuevo dinamismo hace que aumente el número de acuerdos firmados por año. La mayor disponibilidad de oportunidades gracias al desarrollo de la biotecnología ha facilitado en parte este proceso haciendo que un alto % de estos acuerdo se firmen en fases tempranas del desarrollo.
Por otro lado las compañías farmacéuticas están sufriendo una pérdida de rentabilidad del I+D interno al tener los mismos gastos y plazos de desarrollo que antes pero con unos ciclos de vida más cortos y una expectativa de precios más baja.
La solución aparece por sí sola. La firma de acuerdos (ya sean de colaboración o licencia) permite a las compañías acceder a un mayor número de “apuestas” con un coste menor eso sí formulándose con un alto componente variable.
En este entorno es fundamental “estar” en el mercado de productos para no perder oportunidades de negocio pero al mismo tiempo es básico realizar un buen trabajo en el pre, durante y post-acuerdo para “separar el polvo de la paja” y asegurar el éxito a largo plazo que es el que determina el buen desarrollo de una compañía.
Esta creciente necesidad de productos dentro de la industria farmacéutica durante los últimos años así como la necesidad de moverse rápido en un entorno cambiante han sido los principales motivos por los que las compañías farmacéuticas buscan soporte externo en el desarrollo de negocio. La consultoría de desarrollo de negocio no sólo aporta un gran valor a las compañías sino que suponen un recurso de alta calidad, coste-efectivo, complementario y de bajo riesgo.
Como suele pasar en muchos ámbitos de la vida, una parte importante del éxito se consigue gracias a un trabajo intenso y de calidad. “If A equals success, then the formula is: A= X +Y + Z, X is work, Y is play, Z is keep your mouth shut” Albert Einstein
Referencias
1 BD: Business Development
2 New active substances plateau in 2004. www.imshealth.com
3 Elaboración propia basado en Panorama Actual Med. 2005: 29 (Enero-Febrero):1-148
4 Panorama Actual Med. 2005: 29 (julio-agosto):637-756
5 H.G. Grabowski (with DaMasi, J. and Vernon, J.), R&D Costs and Returns by Therapeutic Category, Drug Information Journal (2004) .
6 Royalty rates: current issues and trends, Sharon Finch Medicus publications |























